La isoterma de adsorción de Gibbs para sistemas multicomponente es una ecuación utilizada para relacionar los cambios en la concentración de un componente en contacto con una superficie con cambios en la tensión superficial , lo que resulta en un cambio correspondiente en la energía superficial . Para un sistema binario, la ecuación de adsorción de Gibbs en términos de exceso de superficie es
dónde
Diferentes influencias en la interfaz pueden provocar cambios en la composición de la capa cercana a la superficie. [1] Las sustancias pueden acumularse cerca de la superficie o, por el contrario, moverse hacia la masa. [1] El movimiento de las moléculas caracteriza los fenómenos de adsorción . La adsorción influye en los cambios en la tensión superficial y la estabilidad de los coloides . Las capas de adsorción en la superficie de un medio de dispersión líquido pueden afectar las interacciones de las partículas dispersas en el medio y, en consecuencia, estas capas pueden desempeñar un papel crucial en la estabilidad del coloide [2] La adsorción de moléculas de la fase líquida en una interfaz ocurre cuando este líquido La fase está en contacto con otras fases inmiscibles que pueden ser gaseosas, líquidas o sólidas [3].
La tensión superficial describe lo difícil que es extender el área de una superficie (estirándola o distorsionándola). Si la tensión superficial es alta, se requiere una gran energía libre para aumentar el área superficial, por lo que la superficie tenderá a contraerse y mantenerse unida como una lámina de goma.
Hay varios factores que afectan la tensión superficial, uno de los cuales es que la composición de la superficie puede ser diferente a la del resto. Por ejemplo, si el agua se mezcla con una pequeña cantidad de tensioactivos (por ejemplo, jabón de manos ), el agua a granel puede tener un 99 % de moléculas de agua y un 1 % de moléculas de jabón, pero la superficie superior del agua puede tener un 50 % de moléculas de agua y un 1 % de moléculas de jabón. 50% moléculas de jabón. En este caso, el jabón tiene un "exceso superficial" grande y positivo. En otros ejemplos, el exceso de superficie puede ser negativo: por ejemplo, si se mezcla agua con una sal inorgánica como cloruro de sodio , la superficie del agua es en promedio menos salada y más pura que el promedio general.
Consideremos nuevamente el ejemplo del agua con un poco de jabón. Dado que la superficie del agua necesita tener una mayor concentración de jabón que la masa, cada vez que se aumenta el área de la superficie del agua, es necesario eliminar las moléculas de jabón de la masa y agregarlas a la nueva superficie. Si la concentración de jabón aumenta un poco, las moléculas de jabón estarán más fácilmente disponibles (tienen un mayor potencial químico ), por lo que es más fácil extraerlas del volumen para crear la nueva superficie. Como es más fácil crear una nueva superficie, se reduce la tensión superficial. El principio general es:
Consideremos ahora el ejemplo del agua con sal. La superficie del agua es menos salada que la masa, por lo que cada vez que se aumenta la superficie del agua, es necesario eliminar las moléculas de sal de la nueva superficie y empujarlas a la masa. Si la concentración de sal aumenta un poco (aumentando el potencial químico de la sal ), resulta más difícil expulsar las moléculas de sal. Como ahora es más difícil crear la nueva superficie, la tensión superficial es mayor. El principio general es:
La ecuación de la isoterma de Gibbs proporciona la relación cuantitativa exacta para estas tendencias.

En presencia de dos fases ( α y β ), la superficie (fase superficial) se encuentra entre la fase α y la fase β . Experimentalmente, es difícil determinar la estructura exacta de una fase superficial no homogénea que está en contacto con una fase líquida en masa que contiene más de un soluto. [2] La falta de homogeneidad de la fase superficial es el resultado de la variación de las proporciones molares. [1] Un modelo propuesto por Josiah Willard Gibbs propuso la fase superficial como un modelo idealizado que tenía espesor cero. En realidad, aunque las regiones en masa de las fases α y β son constantes, las concentraciones de los componentes en la región interfacial variarán gradualmente desde la concentración en masa de α hasta la concentración en masa de β a lo largo de la distancia x. Esto contrasta con el modelo idealizado de Gibbs donde la distancia x toma el valor de cero. El diagrama de la derecha ilustra las diferencias entre los modelos real e idealizado.
En el modelo idealizado, los componentes químicos de las fases masivas α y β permanecen sin cambios excepto cuando se acercan a la superficie divisoria. [3] Los moles totales de cualquier componente (los ejemplos incluyen: agua, etilenglicol, etc.) permanecen constantes en las fases masivas, pero varían en la fase superficial para el modelo de sistema real, como se muestra a continuación.
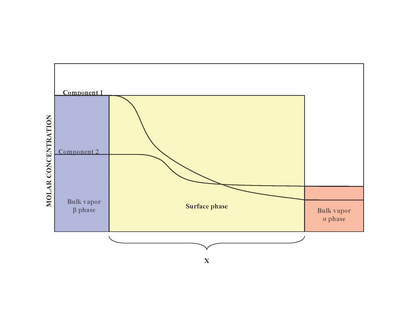
Sin embargo, en el sistema real, el total de moles de un componente varía dependiendo de la ubicación arbitraria de la superficie divisoria. La medida cuantitativa de la adsorción del i -ésimo componente es capturada por el exceso de superficie. [1] El exceso de superficie representa la diferencia entre los moles totales del i -ésimo componente en un sistema y los moles del i -ésimo componente en una fase particular (ya sea α o β ) y está representado por:
donde Γ i es el exceso de superficie del i -ésimo componente, n son los moles, α y β son las fases y A es el área de la superficie divisoria.
Γ representa el exceso de soluto por unidad de área de la superficie sobre lo que estaría presente si la concentración aparente prevaleciera hasta la superficie, puede ser positiva, negativa o cero. Tiene unidades de mol/m 2 .
Las cantidades de exceso de superficie relativa son más útiles que las cantidades de exceso de superficie arbitrarias. [3] El exceso de superficie relativo relaciona la adsorción en la interfaz con un disolvente en la fase masiva. Una ventaja de utilizar las cantidades excedentes relativas de la superficie es que no dependen de la ubicación de la superficie divisoria. Por lo tanto , el exceso de superficie relativo de la especie i y el disolvente 1 es:
Para un sistema de dos fases que consta de las fases α y β en equilibrio con una superficie S que divide las fases, la energía libre de Gibbs total de un sistema se puede escribir como:
donde G es la energía libre de Gibbs.
La ecuación de la isoterma de adsorción de Gibbs se puede derivar de la "particularización de la termodinámica del teorema de Euler en formas homogéneas de primer orden". [4] La energía libre de Gibbs de cada fase α , fase β y fase superficial se puede representar mediante la ecuación:
donde U es la energía interna, p es la presión, V es el volumen, T es la temperatura, S es la entropía y μ i es el potencial químico del i -ésimo componente.
Tomando la derivada total de la forma de Euler de la ecuación de Gibbs para la fase α , la fase β y la fase superficial:
donde A es el área de la superficie divisoria y γ es la tensión superficial .
Para procesos reversibles, la primera ley de la termodinámica requiere que:
donde q es la energía calorífica y w es el trabajo.
Sustituyendo la ecuación anterior en la derivada total de la ecuación de energía de Gibbs y utilizando el resultado, γd A se equipara al trabajo en volumen sin presión cuando se considera la energía superficial:
utilizando la ecuación fundamental de la energía de Gibbs de un sistema multicomponente:
La ecuación que relaciona la fase α , la fase β y la fase superficial se convierte en:
Al considerar las fases en masa ( fase α , fase β ), en equilibrio a temperatura y presión constantes, la ecuación de Gibbs-Duhem requiere que:
La ecuación resultante es la ecuación de la isoterma de adsorción de Gibbs:
La isoterma de adsorción de Gibbs es una ecuación que podría considerarse una isoterma de adsorción que conecta la tensión superficial de una solución con la concentración del soluto.
Para un sistema binario que contiene dos componentes, la ecuación de adsorción de Gibbs en términos de exceso de superficie es:
El potencial químico de la especie i en solución depende de la actividad a usando la siguiente ecuación: [2]
donde μ i es el potencial químico del i -ésimo componente, μ i o es el potencial químico del i -ésimo componente en un estado de referencia, R es la constante de los gases , T es la temperatura y a i es la actividad de el i -ésimo componente.
La diferenciación de la ecuación del potencial químico da como resultado:
donde f es el coeficiente de actividad del componente i y C es la concentración de la especie i en la fase masiva.
Si las soluciones en las fases α y β están diluidas (ricas en un componente particular i ), entonces el coeficiente de actividad del componente i se acerca a la unidad y la isoterma de Gibbs se convierte en:
La ecuación anterior supone que la interfaz es bidimensional, lo que no siempre es cierto. Otros modelos, como el de Guggenheim, corrigen este defecto.
Considere un sistema compuesto de agua que contiene un electrolito orgánico RNaz y un electrolito inorgánico NaCl que se disocian completamente de modo que:
La ecuación de adsorción de Gibbs en términos del exceso de superficie relativo se convierte en:
La relación entre la tensión superficial y el exceso de concentración superficial se convierte en:
donde m es el coeficiente de adsorción de Gibbs. [3] Los valores de m se calculan utilizando los modelos de doble capa (interfacial) de Helmholtz , Gouy y Stern .
Las sustancias pueden tener diferentes efectos sobre la tensión superficial como se muestra: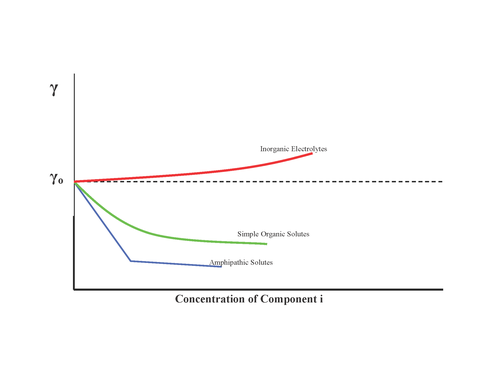
Por lo tanto, la isoterma de Gibbs predice que las sales inorgánicas tienen concentraciones superficiales negativas. Sin embargo, esta visión ha sido cuestionada ampliamente en los últimos años debido a una combinación de experimentos y modelos teóricos más precisos con sensibilidad interfacial, los cuales predicen un aumento en la propensión superficial de los haluros con un tamaño y una polarización crecientes. [5] Como tal, la tensión superficial no es un método confiable para determinar la propensión relativa de los iones hacia la interfaz aire-agua.
Se necesita un método para determinar las concentraciones superficiales para demostrar la validez del modelo: normalmente se utilizan dos técnicas diferentes: la elipsometría y el seguimiento de la desintegración del 14 C presente en las moléculas de tensioactivo.
Los tensioactivos iónicos requieren consideraciones especiales, al ser electrolitos :
donde se refiere a la concentración superficial de moléculas de surfactante, sin considerar el contraión.

El grado de adsorción en una interfaz líquida se puede evaluar utilizando los datos de concentración de tensión superficial y la ecuación de adsorción de Gibbs. [3] El método de la hoja del microtomo se utiliza para determinar el peso y la concentración molar de una interfaz. El método implica obtener una porción de un metro cuadrado de interfaz aire-líquido de soluciones binarias utilizando una cuchilla de microtomo .
Otro método que se utiliza para determinar el grado de adsorción en una interfaz aire-agua es la técnica de emulsión, que se puede utilizar para estimar el exceso superficial relativo con respecto al agua. [3]
Además, el exceso de superficie de Gibbs de un componente tensioactivo para una solución acuosa se puede encontrar utilizando el método del trazador radiactivo . El componente tensioactivo suele estar marcado con carbono-14 o azufre-35. [3]