Un ion hidrógeno se crea cuando un átomo de hidrógeno pierde un electrón . Un ion hidrógeno cargado positivamente (o protón ) puede combinarse fácilmente con otras partículas y, por lo tanto, solo se ve aislado cuando está en estado gaseoso o en un espacio casi libre de partículas. [1] Debido a su densidad de carga extremadamente alta de aproximadamente 2×10 10 veces la de un ion sodio, el ion hidrógeno desnudo no puede existir libremente en solución ya que se hidrata fácilmente, es decir, se une rápidamente. [2] La IUPAC recomienda el ion hidrógeno como término general para todos los iones de hidrógeno y sus isótopos . [3] Dependiendo de la carga del ion, se pueden distinguir dos clases diferentes: iones con carga positiva e iones con carga negativa.

Un átomo de hidrógeno está formado por un núcleo con carga +1 y un solo electrón. Por lo tanto, el único ion con carga positiva posible es el que tiene carga +1. Se escribe H + .
Dependiendo del isótopo en cuestión, el catión hidrógeno tiene diferentes nombres:
Además, los iones producidos por la reacción de estos cationes con el agua así como sus hidratos se denominan iones de hidrógeno:
Los cationes Zundel y los cationes Eigen juegan un papel importante en la difusión de protones según el mecanismo de Grotthuss .
En relación con los ácidos, los "iones de hidrógeno" normalmente se refieren a hidrones.
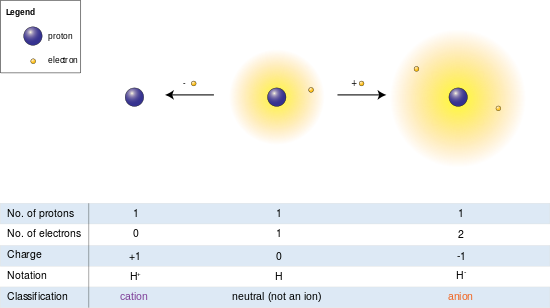
En la imagen de la izquierda, el átomo de hidrógeno (centro) contiene un único protón y un único electrón. La eliminación del electrón da lugar a un catión (izquierda), mientras que la adición de un electrón da lugar a un anión (derecha). El anión de hidrógeno, con su nube de dos electrones débilmente unida, tiene un radio mayor que el átomo neutro, que a su vez es mucho mayor que el protón desnudo del catión. El hidrógeno forma el único catión que no tiene electrones, pero incluso los cationes que (a diferencia del hidrógeno) aún conservan uno o más electrones son aún más pequeños que los átomos o moléculas neutros de los que se derivan.
Los aniones de hidrógeno se forman cuando se adquieren electrones adicionales:
Los iones de hidrógeno impulsan la ATP sintasa en la fotosíntesis . Esto sucede cuando los iones de hidrógeno son empujados a través de la membrana creando una alta concentración dentro de la membrana del tilacoide y una baja concentración en el citoplasma. Sin embargo, debido a la ósmosis, el H + se forzará a salir de la membrana a través de la ATP sintasa. Usando su energía cinética para escapar, los protones harán girar la ATP sintasa que a su vez creará ATP . Esto sucede también en la respiración celular , aunque la membrana concentrada será en cambio la membrana interna de las mitocondrias .
La concentración de iones de hidrógeno, medida como pH, también es responsable de la naturaleza ácida o básica de un compuesto. Las moléculas de agua se dividen para formar aniones H + e hidróxido. Este proceso se conoce como autoionización del agua .
La concentración de iones de hidrógeno y el pH son inversamente proporcionales; en una solución acuosa, una mayor concentración de iones de hidrógeno produce un pH bajo y, posteriormente, un producto ácido. Por definición, un ácido es un ion o molécula que puede donar un protón y, cuando se introduce en una solución, reaccionará con moléculas de agua (H 2 O) para formar un ion hidronio (H 3 O + ), un ácido conjugado del agua. [4] Para simplificar, el ion hidrógeno (H + ) se utiliza a menudo para abreviar el ion hidronio.
La acidificación de los océanos es la consecuencia directa de las elevadas concentraciones de iones de hidrógeno y la saturación de carbonatos por la absorción significativa de dióxido de carbono (CO 2 ) por los océanos del mundo. [5] El estado preindustrial de la química de carbonatos del océano ha sido notablemente estable, incluido el equilibrio de su pH. [6] Después de la revolución industrial, las emisiones antropogénicas de la quema de combustibles fósiles , la producción de cemento y los cambios en el uso de la tierra han aumentado la absorción de dióxido de carbono de la atmósfera por los océanos en un 30%. [7] En el océano, la capacidad de absorción de este gas de efecto invernadero es 59 veces mayor que en la atmósfera; [8] el océano actúa como el mayor sumidero de carbono del planeta, desempeñando un papel importante en la regulación del clima. [9] Además de los flujos de carbono, el proceso natural de secuestro de carbono de la atmósfera hacia las profundidades del océano se ve facilitado por dos sistemas, la bomba biológica y la bomba de solubilidad. La bomba de solubilidad es un proceso físico-químico que transfiere CO 2 en la interfaz aire-mar. [10] Según la Ley de Henry, la cantidad de CO 2 disuelto en una solución acuosa es directamente proporcional a la presión parcial de CO 2 en la atmósfera. [11] Para mantener el equilibrio, un estado de alta presión parcial atmosférica de CO 2 conduce a un mayor intercambio oceánico de este gas por difusión molecular.
En las aguas superficiales, el dióxido de carbono atmosférico disuelto (CO 2(aq) ) reacciona con las moléculas de agua para formar ácido carbónico (H 2 CO 3 ), un ácido diprótico débil. Los ácidos dipróticos constan de dos átomos de hidrógeno ionizables en cada molécula. [12] En una solución acuosa, la disociación parcial del ácido carbónico libera un protón de hidrógeno (H + ) y un ion bicarbonato (HCO 3 − ), y posteriormente, el ion bicarbonato se disocia en un protón de hidrógeno adicional y un ion carbonato (CO 3 2- ). [13] La disolución y disociación de estas especies de carbono inorgánico genera un aumento en la concentración de iones de hidrógeno y reduce inversamente el pH superficial del océano ambiental. El sistema de amortiguación de carbonato regula la acidez del agua de mar al mantener las especies de carbono inorgánico disueltas en equilibrio químico.
La ecuación química consta de reactivos y productos que pueden reaccionar en cualquier dirección. Más reactivos añadidos a un sistema producen más producción de producto (la reacción química se desplaza hacia la derecha) y si se añade más producto, se formarán reactivos adicionales, desplazando la reacción química hacia la izquierda. Por lo tanto, en este modelo, una alta concentración del reactivo inicial, dióxido de carbono, produce una mayor cantidad de producto final (H + y CO 3 2- ), lo que reduce el pH y crea una solución más ácida. El sistema de amortiguación natural del océano resiste el cambio de pH produciendo más iones de bicarbonato generados por protones ácidos libres que reaccionan con iones de carbonato para formar un carácter alcalino. [14] Sin embargo, el aumento de las concentraciones atmosféricas de CO 2 puede superar el umbral de capacidad de amortiguación, lo que resulta en mayores tasas de acidificación del océano. Los cambios en la química de carbonato del océano tienen el potencial de manipular los ciclos biogeoquímicos oceánicos para muchos elementos y compuestos, lo que causa profundos impactos en los ecosistemas marinos. Además, la solubilidad del CO 2 depende de la temperatura; Las temperaturas elevadas de las aguas superficiales reducen la solubilidad del CO2 . Un aumento continuo de la presión parcial atmosférica del CO2 podría hacer que el océano pase de actuar como sumidero (el transporte vertical de carbono a las profundidades del océano) a convertirse en una fuente (desgasificación del CO2 del océano), lo que aumentaría aún más las temperaturas globales. [15]