La inducción asimétrica (también enantioinducción ) describe la formación preferencial en una reacción química de un enantiómero o diastereoisómero sobre el otro como resultado de la influencia de una característica quiral presente en el sustrato , reactivo , catalizador o entorno. [1] La inducción asimétrica es un elemento clave en la síntesis asimétrica .
La inducción asimétrica fue introducida por Hermann Emil Fischer basándose en su trabajo sobre los carbohidratos . [2] Existen varios tipos de inducción.
La inducción asimétrica interna hace uso de un centro quiral unido al centro reactivo a través de un enlace covalente y permanece así durante la reacción. El material de partida a menudo se deriva de la síntesis de pool quirales . En la inducción asimétrica retransmitida la información quiral se introduce en un paso separado y se elimina nuevamente en una reacción química separada. Los sintones especiales se denominan auxiliares quirales . En la inducción asimétrica externa la información quiral se introduce en el estado de transición a través de un catalizador de ligando quiral . Este método de síntesis asimétrica es el más conveniente desde el punto de vista económico. [ aclaración necesaria ]
Existen varios modelos para describir la inducción quiral en los carbonos carbonílicos durante las adiciones nucleofílicas. Estos modelos se basan en una combinación de consideraciones estéricas y electrónicas y a menudo entran en conflicto entre sí. Cram (1952), Cornforth (1959), Felkin (1969) y otros han ideado modelos.
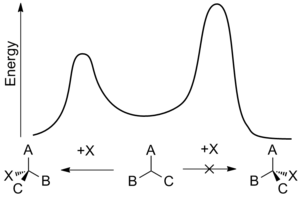
La regla de Cram de inducción asimétrica, llamada así en honor a Donald J. Cram, establece que en ciertas reacciones no catalíticas predominará el diastereómero, que podría formarse por la aproximación del grupo entrante desde el lado menos impedido cuando la conformación rotacional del enlace CC es tal que el doble enlace está flanqueado por los dos grupos menos voluminosos unidos al centro asimétrico adyacente. [3] La regla indica que la presencia de un centro asimétrico en una molécula induce la formación de un centro asimétrico adyacente a él con base en el impedimento estérico ( esquema 1 ).
Los experimentos implicaron dos reacciones. En el experimento, se hizo reaccionar un 2-fenilpropionaldehído ( 1 , racémico pero enantiómero (R) mostrado) con el reactivo de Grignard de bromobenceno para formar 1,2-difenil-1-propanol ( 2 ) como una mezcla de diastereómeros , predominantemente el isómero treo (véase la explicación en la proyección de Fischer ).
La preferencia por la formación del isómero treo se puede explicar por la regla establecida anteriormente al tener el nucleófilo activo en esta reacción atacando al grupo carbonilo desde el lado menos impedido (ver proyección de Newman A ) cuando el carbonilo está posicionado en una formación escalonada con el grupo metilo y el átomo de hidrógeno , que son los dos sustituyentes más pequeños que crean un mínimo de impedimento estérico , en una orientación gauche y el fenilo como el grupo más voluminoso en la conformación anti .
La segunda reacción es la reducción orgánica de 1,2-difenil-1-propanona 2 con hidruro de litio y aluminio , que da como resultado el mismo producto de reacción que el anterior, pero ahora con preferencia por el isómero eritro ( 2a ). Ahora, un anión hidruro (H − ) es el nucleófilo que ataca desde el lado menos impedido (imaginemos que el hidrógeno entra desde el avión de papel).
El modelo de Felkin (1968), llamado así por Hugh Felkin, también predice la estereoquímica de las reacciones de adición nucleofílica a los grupos carbonilo . [4] Felkin argumentó que el modelo de Cram adolecía de un inconveniente importante: una conformación eclipsada en el estado de transición entre el sustituyente carbonilo (el átomo de hidrógeno en los aldehídos) y el sustituyente α-carbonilo más grande. Demostró que al aumentar el volumen estérico del sustituyente carbonilo de metilo a etilo a isopropilo a terc-butilo , la estereoselectividad también aumentaba, lo que no predice la regla de Cram:
Las reglas de Felkin son:
El modelo Felkin-Anh [5] es una extensión del modelo Felkin que incorpora mejoras sugeridas por Nguyễn Trọng Anh y Odile Eisenstein para corregir dos debilidades clave en el modelo de Felkin. La primera debilidad abordada fue la declaración de Felkin de un fuerte efecto polar en los estados de transición de adición nucleofílica, que conduce a la inversión completa de la estereoquímica por reacciones S N 2 , sin ofrecer justificaciones de por qué se observó este fenómeno. La solución de Anh fue ofrecer el efecto antiperiplanar como consecuencia de la inducción asimétrica controlada tanto por efectos de sustituyentes como de orbitales. [6] [7] En este efecto, el mejor orbital σ* aceptor de nucleófilos se alinea en paralelo a los orbitales π y π* del carbonilo, que proporcionan estabilización del anión entrante.
La segunda debilidad del modelo de Felkin fue el supuesto de minimización de sustituyentes alrededor del carbonilo R, lo que no puede aplicarse a los aldehídos.
La incorporación de las ideas del ángulo de Bürgi-Dunitz [8] [9] permitió a Anh postular un ataque no perpendicular del nucleófilo al centro carbonílico, en cualquier lugar entre 95° y 105° en relación con el doble enlace oxígeno-carbono, favoreciendo un enfoque más cercano al sustituyente más pequeño y, por lo tanto, resolviendo el problema de la previsibilidad de los aldehídos. [6] [10] [11]
Aunque los modelos de Cram y Felkin–Anh difieren en los conformadores considerados y otras suposiciones, ambos intentan explicar el mismo fenómeno básico: la adición preferencial de un nucleófilo a la cara más favorecida estéricamente de una fracción carbonílica . Sin embargo, existen muchos ejemplos de reacciones que muestran una estereoselectividad opuesta a la predicha por los principios básicos de los modelos de Cram y Felkin–Anh. Aunque ambos modelos incluyen intentos de explicar estas inversiones, los productos obtenidos todavía se denominan productos "anti-Felkin". Uno de los ejemplos más comunes de selectividad de inducción asimétrica alterada requiere un carbono α sustituido con un componente con carácter de base de Lewis (es decir, sustituyentes O, N, S, P). En esta situación, si se introduce un ácido de Lewis como Al-iPr 2 o Zn 2+ , se puede observar un efecto de quelación bidentada . Esto bloquea el carbonilo y el sustituyente de base de Lewis en una conformación eclipsada, y el nucleófilo atacará entonces desde el lado con el sustituyente de carbono α libre más pequeño. [12] Si el grupo quelante R se identifica como el más grande, esto dará como resultado un producto "anti-Felkin".
Este control estereoselectivo fue reconocido y discutido en el primer artículo que estableció el modelo de Cram, lo que llevó a Cram a afirmar que su modelo requiere condiciones no quelantes. [13] Un ejemplo de control de quelación de una reacción se puede ver aquí, de un artículo de 1987 que fue el primero en observar directamente un intermediario "quelato-Cram", [14] reivindicando el modelo:
En este caso, el cloruro de metil titanio forma un quelato de Cram. El grupo metilo se disocia del titanio y ataca al carbonilo, lo que da lugar al diastereómero anti-Felkin.
Un efecto sustituyente atractor de electrones no quelante también puede dar lugar a una selectividad anti-Felkin. Si un sustituyente en el carbono α es suficientemente atractor de electrones, el nucleófilo añadirá anti- en relación con el grupo atractor de electrones , incluso si el sustituyente no es el más grande de los 3 unidos al carbono α. Cada modelo ofrece una explicación ligeramente diferente para este fenómeno. Un efecto polar fue postulado por el modelo de Cornforth [15] y el modelo original de Felkin [16] , que colocaba el sustituyente EWG y el nucleófilo entrante anti - entre sí para cancelar de forma más eficaz el momento dipolar de la estructura de transición .
Esta proyección de Newman ilustra el estado de transición de Cornforth y Felkin que coloca al EWG en anti- respecto del nucleófilo entrante , independientemente de su volumen estérico en relación con R S y R L .
El modelo Felkin-Anh mejorado, como se ha comentado anteriormente, permite realizar una evaluación más sofisticada del efecto polar al considerar las interacciones orbitales moleculares en la estabilización del estado de transición preferido. A continuación se muestra una reacción típica que ilustra la posible selectividad anti-Felkin de este efecto, junto con su estructura de transición propuesta :
Se ha observado que el entorno estereoelectrónico en el carbono β también puede dirigir la inducción asimétrica. A lo largo de los años se han desarrollado varios modelos predictivos para definir la estereoselectividad de dichas reacciones.
Según Reetz, el modelo de quelato de Cram para las inducciones 1,2 se puede ampliar para predecir el complejo quelado de un aldehído β-alcoxi y un metal. Se observa que el nucleófilo ataca desde el lado menos impedido estéricamente y en anti- con respecto al sustituyente R β , lo que conduce al aducto anti- como producto principal. [17]
Para formar dichos quelatos, el centro metálico debe tener al menos dos sitios de coordinación libres y los ligandos protectores deben formar un complejo bidentado con el ácido de Lewis.
Cram y Reetz demostraron que el estereocontrol 1,3 es posible si la reacción procede a través de un estado de transición acíclico. La reacción del aldehído β-alcoxi con aliltrimetilsilano mostró una buena selectividad para el anti -1,3-diol, lo que se explicó mediante el modelo polar de Cram. El grupo benciloxi polar está orientado en sentido anti al carbonilo para minimizar las interacciones dipolares y el nucleófilo ataca en sentido anti al sustituyente más voluminoso (R M ) de los dos sustituyentes restantes. [18] [19]
Más recientemente, Evans presentó un modelo diferente para las inducciones 1,3-no quelantes. En el estado de transición propuesto, el estereocentro β está orientado en sentido anti- al nucleófilo entrante, como se observa en el modelo de Felkin-Anh. El grupo polar X en el estereocentro β está situado en sentido anti- al carbonilo para reducir las interacciones dipolares, y Rβ está situado en sentido anti- al grupo aldehído para minimizar el impedimento estérico. En consecuencia, se predeciría que el 1,3- anti -diol sería el producto principal. [20]
Si el sustrato tiene un estereocentro α y β, se deben considerar al mismo tiempo la regla de Felkin-Anh (inducción 1,2) y el modelo de Evans (inducción 1,3). Si estos dos estereocentros tienen una relación anti , ambos modelos predicen el mismo diastereómero (caso de estereorreforzamiento).
Sin embargo, en el caso del sustrato sin, el modelo de Felkin-Anh y el de Evans predicen productos diferentes (caso de no estereorreforzamiento). Se ha descubierto que el tamaño del nucleófilo entrante determina el tipo de control ejercido sobre la estereoquímica. En el caso de un nucleófilo grande, la interacción del estereocentro α con el nucleófilo entrante se vuelve dominante; por lo tanto, el producto de Felkin es el principal. Los nucleófilos más pequeños, por otro lado, dan como resultado un control 1,3 que determina la asimetría. [21]
Los alquenos acíclicos quirales también muestran diastereoselectividad en reacciones como la epoxidación y la alquilación de enolatos. Los sustituyentes alrededor del alqueno pueden favorecer la aproximación del electrófilo desde una u otra cara de la molécula. Esta es la base del modelo de Houk , basado en el trabajo teórico de Kendall Houk , que predice que la selectividad es más fuerte para los dobles enlaces cis que para los trans . [22]
En el ejemplo mostrado, el alqueno cis asume la conformación mostrada para minimizar el choque estérico entre R S y el grupo metilo. La aproximación del electrófilo ocurre preferentemente desde el mismo lado del grupo medio (R M ) en lugar del grupo grande (R L ), produciendo principalmente el diastereoisómero mostrado. Dado que para un alqueno trans el impedimento estérico entre R S y el grupo H no es tan grande como para el caso cis , la selectividad es mucho menor.



La inducción asimétrica por la estructura molecular de un sustrato acíclico es la idea de que las propiedades electrónicas y estéricas asimétricas de una molécula pueden determinar la quiralidad de las reacciones químicas subsiguientes en esa molécula. Este principio se utiliza para diseñar síntesis químicas en las que hay un estereocentro y se requieren estereocentros adicionales.
Al considerar cómo reaccionan dos grupos funcionales o especies, las configuraciones 3D precisas de las entidades químicas involucradas determinarán cómo pueden aproximarse entre sí. Cualquier restricción en cuanto a cómo estas especies pueden aproximarse entre sí determinará la configuración del producto de la reacción. En el caso de la inducción asimétrica, estamos considerando los efectos de un centro asimétrico en una molécula sobre la reactividad de otros grupos funcionales en esa molécula. Cuanto más cerca estén estos dos sitios, mayor será la influencia que se espera observar. Un enfoque más holístico para evaluar estos factores es mediante el modelado computacional [23] , sin embargo, también se pueden utilizar factores cualitativos simples para explicar las tendencias predominantes observadas en algunos pasos sintéticos. La facilidad y precisión de este enfoque cualitativo significa que se aplica más comúnmente en la síntesis y el diseño de sustratos. Ejemplos de marcos moleculares apropiados son los aldehídos quirales alfa y el uso de auxiliares quirales.
La posible reactividad en aldehídos incluye el ataque nucleofílico y la adición de alilmetales. La estereoselectividad del ataque nucleofílico en aldehídos alfa-quirales puede describirse mediante los modelos Felkin-Anh o Felkin Anh polar y la adición de alilmetales aquirales puede describirse mediante la regla de Cram.
La selectividad en las adiciones nucleofílicas a los aldehídos quirales se explica a menudo mediante el modelo Felkin-Anh [24] (véase la figura). El nucleófilo se aproxima al carbono del grupo carbonilo en el ángulo de Burgi-Dunitz . [25] En esta trayectoria, el ataque desde la cara inferior se ve desfavorecido debido al volumen estérico del grupo funcional adyacente de gran tamaño.
El modelo polar Felkin-Anh se aplica en el escenario donde X es un grupo electronegativo. El modelo polar Felkin-Anh postula que la estereoquímica observada surge debido a la estabilización hiperconjugativa que surge de la interacción antiperiplanar entre el orbital antienlazante σ* de CX y el enlace en formación.
Se puede mejorar la selectividad de Felkin-Anh para las adiciones de organometales a los aldehídos utilizando nucleófilos de organoaluminio en lugar de los correspondientes nucleófilos de Grignard o de organolitio. Claude Spino y colaboradores [26] han demostrado mejoras significativas en la estereoselectividad al cambiar de reactivos de vinil-grignard a reactivos de vinil-alano con varios aldehídos quirales.
La adición de alilmetales aquirales a aldehídos forma un alcohol quiral; el resultado estereoquímico de esta reacción está determinado por la quiralidad del carbono α en el sustrato de aldehído (Figura "Control del sustrato: adición de alilmetales aquirales a aldehídos α-quirales"). Los reactivos de alilmetales utilizados incluyen boro , estaño y titanio .
La regla de Cram explica la estereoselectividad considerando el estado de transición representado en la figura 3. En el estado de transición, el par solitario de oxígeno puede interactuar con el centro de boro mientras que el grupo alilo puede agregarse al extremo de carbono del grupo carbonilo. La demanda estérica de este estado de transición se minimiza por la configuración de carbono α que mantiene al grupo más grande alejado (en trans) del grupo carbonilo congestionado y el grupo alilmetal se acerca más allá del grupo más pequeño en el centro de carbono α. En el ejemplo siguiente (Figura "Un ejemplo de adición controlada por sustrato de alil-boro aquiral a aldehído α-quiral"), (R)-2-metilbutanal (1) reacciona con el reactivo alilboro (2) con dos diastereoisómeros posibles de los cuales el isómero (R, R) es el producto principal. El modelo de Cram de esta reacción se muestra con el grupo carbonilo colocado en trans respecto del grupo etilo (el grupo grande) y el alilboro se acerca más allá del hidrógeno (el grupo pequeño). La estructura se muestra en proyección de Newman . En este caso, la reacción de adición nucleofílica ocurre en la cara donde se encuentra el hidrógeno (el grupo pequeño), dando como resultado el isómero (R, R) como producto mayoritario.
La estereoinducción asimétrica se puede lograr con el uso de auxiliares quirales. Los auxiliares quirales se pueden unir de forma reversible al sustrato, lo que induce una reacción diastereoselectiva antes de la escisión, lo que produce un proceso enantioselectivo. Entre los ejemplos de auxiliares quirales se incluyen los auxiliares de oxazolidinona quirales de Evans (para reacciones aldólicas asimétricas) [27], las amidas de pseudoefedrina y las iminas de terc-butanosulfinamida .
Las moléculas cíclicas a menudo existen en conformaciones mucho más rígidas que sus contrapartes lineales. Incluso los macrociclos muy grandes como la eritromicina existen en geometrías definidas a pesar de tener muchos grados de libertad. Debido a estas propiedades, a menudo es más fácil lograr una inducción asimétrica con sustratos macrocíclicos en lugar de lineales. Los primeros experimentos realizados por W. Clark Still [28] y colegas mostraron que las moléculas orgánicas de anillo mediano y grande pueden proporcionar niveles sorprendentes de inducción estereoscópica como sustratos en reacciones como la alquilación cinética de enolato , la adición de dimetilcuprato y la hidrogenación catalítica . Incluso un solo grupo metilo suele ser suficiente para sesgar el resultado diastereomérico de la reacción. Estos estudios, entre otros, ayudaron a desafiar la creencia científica ampliamente aceptada de que los anillos grandes son demasiado flexibles para proporcionar cualquier tipo de control estereoquímico.
Varias síntesis totales han hecho uso del estereocontrol macrocíclico para lograr los productos de reacción deseados. En la síntesis de (−)-cladiella-6,11-dien-3-ol, [29] una olefina trisustituida deformada se dihidroxiló diasetereoselectivamente con N -óxido de N -metilmorfolina (NMO) y tetróxido de osmio , en presencia de una olefina no deformada. En el camino hacia la (±)-periplanona B, [30] los químicos lograron una epoxidación selectiva facial de un intermedio de enona usando hidroperóxido de terc-butilo en presencia de otros dos alquenos. La reducción con borohidruro de sodio de un intermedio de enona de anillo de 10 miembros en el camino hacia el sesquiterpeno eucannabinolida [31] se desarrolló como lo predijeron los cálculos de modelado molecular que dieron cuenta de la conformación de macrociclo de energía más baja . Los esquemas sintéticos controlados por sustrato tienen muchas ventajas, ya que no requieren el uso de reactivos asimétricos complejos para lograr transformaciones selectivas.
En síntesis orgánica , el control de reactivos es un enfoque para formar selectivamente un estereoisómero de entre muchos; la estereoselectividad está determinada por la estructura y la quiralidad del reactivo utilizado. Cuando se utilizan alilmetales quirales para la reacción de adición nucleofílica a aldehídos aquirales , la quiralidad del carbono de alcohol recién generado está determinada por la quiralidad de los reactivos alilmetales (Figura 1). La quiralidad de los alilmetales generalmente proviene de los ligandos asimétricos utilizados. Los metales en los reactivos alilmetales incluyen boro , estaño , titanio , silicio , etc.

Se han desarrollado varios ligandos quirales para preparar alilmetales quirales para la reacción con aldehídos. HC Brown fue el primero en informar sobre los reactivos de alilboro quirales para reacciones de alilación asimétrica con aldehídos. [32] Los reactivos de alilboro quirales se sintetizaron a partir del producto natural (+)-a-pineno en dos pasos. Los ligandos TADDOL desarrollados por Dieter Seebach se han utilizado para preparar compuestos de aliltitanio quirales para la alilación asimétrica con aldehídos. [33] Jim Leighton ha desarrollado compuestos de alilsilicio quirales en los que la liberación de la tensión del anillo facilitó la reacción de alilación estereoselectiva; se pudo lograr un exceso enantiomérico del 95% al 98% para una variedad de aldehídos aquirales. [34]
