
Los carboximidatos (o más generalmente imidatos ) son compuestos orgánicos, que pueden considerarse como ésteres formados entre un ácido imídico (RC(=NR')OH) y un alcohol , con la fórmula general RC(=NR')OR".
También se conocen como imino éteres , ya que se asemejan a las iminas (>C=N-) con un átomo de oxígeno conectado al átomo de carbono del doble enlace C=N. [1]
Los imidatos se pueden generar mediante diversas vías sintéticas [2] , pero en general se forman mediante la reacción de Pinner , que se produce mediante el ataque catalizado por ácidos de los nitrilos por alcoholes.

Los imidatos producidos de esta manera se forman como sales de clorhidrato, que a veces se denominan sales de Pinner. Los carboximidatos también se forman como intermediarios en la transposición de Mumm y la transposición de Overman .
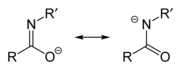
Un anión amidato/imidato se forma tras la desprotonación de una amida o un ácido imídico . Dado que las amidas y los ácidos imídicos son tautómeros , forman el mismo anión tras la desprotonación. Por tanto, los dos nombres son sinónimos que describen el mismo anión, aunque podría decirse que imidato se refiere al contribuyente de resonancia de la izquierda, mientras que amidato se refiere al contribuyente de resonancia de la derecha. Sin embargo, se distinguen cuando actúan como ligandos para metales de transición, y las especies unidas a O se denominan imidatos y las especies unidas a N se denominan amidatos. Pueden considerarse análogos aza-sustituidos de enolatos con la fórmula RN=C(O − )R.
Los carboximidatos son buenos electrófilos y experimentan una variedad de reacciones de adición; los imidatos alifáticos generalmente reaccionan más rápido que los imidatos aromáticos . [2] Se pueden hidrolizar para dar ésteres y, mediante un proceso análogo, reaccionar con aminas (incluido el amoníaco) para formar amidinas . Los imidatos alifáticos reaccionan con un exceso de alcohol bajo catálisis ácida para formar ortoésteres RC(OR) 3 , los imidatos aromáticos también se pueden convertir, pero con mucha menos facilidad.

El reordenamiento de Chapman es la conversión térmica de N -arilbenzimidatos de arilo en las amidas correspondientes, a través de la migración intramolecular de un grupo arilo del oxígeno al nitrógeno. [4] Lleva el nombre de Arthur William Chapman, quien lo describió por primera vez, [5] y es conceptualmente similar al reordenamiento de Newman-Kwart .

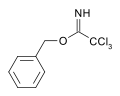
Los carboximidatos pueden actuar como grupo protector de los alcoholes. [6] Por ejemplo, la reacción catalizada por una base del alcohol bencílico sobre el tricloroacetonitrilo produce un tricloroacetimidato. Esta especie tiene estabilidad ortogonal a las protecciones de acetato y TBS y puede escindirse por hidrólisis ácida. [7]