La catálisis por enlaces de hidrógeno es un tipo de organocatálisis que se basa en el uso de interacciones por enlaces de hidrógeno para acelerar y controlar reacciones orgánicas . En los sistemas biológicos, los enlaces de hidrógeno desempeñan un papel clave en muchas reacciones enzimáticas, tanto en la orientación de las moléculas del sustrato como en la reducción de las barreras a la reacción. [1] El campo está relativamente poco desarrollado en comparación con la investigación en catálisis ácida de Lewis . [2]
Los donantes de enlaces de hidrógeno pueden catalizar reacciones a través de una variedad de mecanismos. Los enlaces de hidrógeno pueden estabilizar los intermediarios aniónicos. Secuestran aniones, permitiendo la formación de cationes electrófilos reactivos. Los donantes más ácidos pueden actuar como ácidos generales o específicos, que activan los electrófilos mediante protonación. Un enfoque potente es la activación simultánea de ambos participantes en una reacción, por ejemplo nucleófilo y electrófilo, denominada "catálisis bifuncional". En todos los casos, la estrecha asociación de la molécula del catalizador con el sustrato también hace que la catálisis por enlace de hidrógeno sea un método poderoso para inducir enantioselectividad .
Los catalizadores de enlaces de hidrógeno suelen ser sencillos de fabricar, relativamente robustos y pueden sintetizarse con una alta pureza enantiomérica. Se están descubriendo a un ritmo cada vez mayor nuevas reacciones catalizadas por donantes de enlaces de hidrógeno, incluidas variantes asimétricas de reacciones orgánicas comunes, como adiciones aldólicas , cicloadiciones de Diels-Alder y reacciones de Mannich . [3]
Muchas reacciones orgánicas implican la formación de intermedios tetraédricos mediante el ataque nucleofílico de grupos funcionales como aldehídos , amidas o iminas . En estos casos, la catálisis con donantes de enlaces de hidrógeno es una estrategia atractiva ya que los intermedios tetraédricos aniónicos son mejores aceptores de enlaces de hidrógeno que el compuesto de partida. Esto significa que, en relación con el complejo catalizador-sustrato inicial, se estabiliza el estado de transición, que tiene más carga negativa.

Por ejemplo, en una reacción de sustitución de acilo típica, el compuesto carbonilo de partida está coordinado con el catalizador a través de uno, dos o posiblemente más enlaces de hidrógeno. Durante el ataque del nucleófilo, se acumula carga negativa en el oxígeno hasta que se alcanza el intermedio tetraédrico. Por lo tanto, el oxígeno formalmente negativo forma un enlace de hidrógeno mucho más fuerte que el oxígeno carbonílico inicial debido a su mayor carga negativa. Energéticamente, esto tiene el efecto de reducir el estado intermedio y de transición , acelerando así la reacción.
Este modo de catálisis se encuentra en los sitios activos de muchas enzimas , como las serina proteasas . [4] En este ejemplo, la amida carbonilo está coordinada con dos donantes de N – H. Estos sitios de coordinación múltiple diseñados para promover reacciones carbonílicas en biología se denominan " agujeros de oxianión ". La entrega de nucleófilo de serina forma un intermedio tetraédrico, que se estabiliza mediante el aumento de los enlaces de hidrógeno con el agujero oxianión.

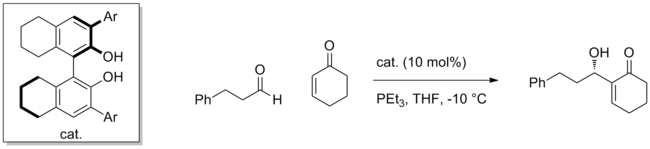
Muchos catalizadores sintéticos emplean esta estrategia para activar una variedad de electrófilos. Utilizando un catalizador quiral BINOL , por ejemplo, se puede realizar con alta enantioselectividad la reacción de Morita-Baylis-Hillman mediante la adición de enonas a aldehídos. [5] El nucleófilo es una especie de tipo enolato generada a partir de la adición conjugada de PEt 3 a la enona, y se agrega enantioselectivamente al aldehído coordinado al catalizador.
Además de los carbonilos, se pueden utilizar otros electrófilos como, por ejemplo, iminas. Por ejemplo, utilizando un catalizador de tiourea quiral simple, la reacción asimétrica de Mannich de iminas aromáticas con acetales de silil ceteno se puede catalizar con un alto ee en una conversión casi cuantitativa. [6] El mecanismo de esta reacción no está completamente resuelto y la reacción es muy específica del sustrato, solo efectiva en ciertos electrófilos aromáticos.
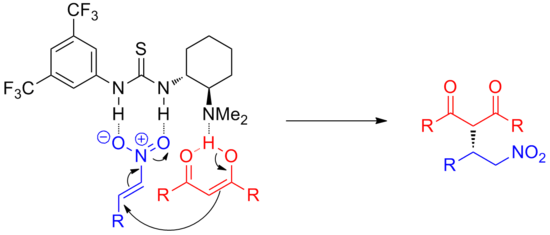
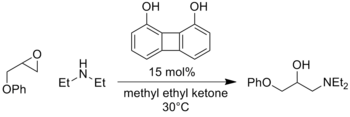
El alcance de este modo de activación incluye combinaciones de electrófilos, nucleófilos y estructuras catalíticas. Además, con esta estrategia también se han catalizado reacciones análogas que involucran intermedios de oxianión, como la adición de enolato a compuestos nitrosos [7] o la apertura de epóxidos [8] .
Otra estrategia que se ha explorado es la estabilización de reacciones que desarrollan cargas negativas parciales en el estado de transición. Ejemplos de aplicaciones son las reacciones más comunes que se aproximan a la naturaleza concertada y pericíclica. Durante el curso de la reacción, un fragmento desarrolla un carácter parcialmente negativo y el estado de transición puede estabilizarse aceptando enlaces de hidrógeno.
Un ejemplo demostrativo es la catálisis de los reordenamientos de Claisen de éteres alil vinílicos sustituidos con éster, informada por el grupo de investigación Jacobsen. [9] Se descubrió que un catalizador quiral de guanidinio promueve la reacción cerca de la temperatura ambiente con alta enantioselectividad. Durante el estado de transición, el fragmento coordinado con el catalizador de amidinio desarrolla un carácter aniónico parcial debido a la electronegatividad del oxígeno y del grupo éster aceptor de electrones. Esto aumenta la fuerza de los enlaces de hidrógeno y reduce la energía del estado de transición, acelerando así la reacción.

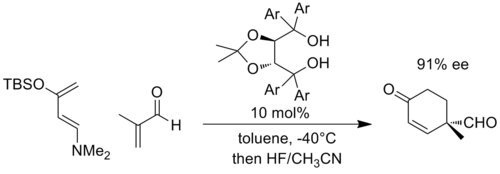
De manera similar, se puede desarrollar carga negativa en reacciones de cicloadición como la reacción de Diels-Alder , cuando los socios se sustituyen adecuadamente. Como ejemplo representativo, Rawal y sus compañeros desarrollaron un catalizador quiral basado en α,α,α',α'-tetraaril-2,2-disustituido 1,3-dioxolano-4,5-dimetanol ( TADDOL ) que podría catalizar Diels- Reacciones del aliso. En el siguiente ejemplo, se cree que la reacción con un dieno altamente rico en electrones y un dienófilo pobre en electrones desarrolla una carga negativa significativa en el fragmento enal, y el estado de transición se estabiliza mediante un aumento de los enlaces de hidrógeno con el TADDOL (Ar = 1 -naftilo). [10]
Los catalizadores de enlaces de hidrógeno también pueden acelerar reacciones ayudando en la formación de especies electrófilas mediante la abstracción y coordinación de un anión como un haluro. Los catalizadores de urea y tiourea son los donadores más comunes en la catálisis de unión aniónica, y su capacidad para unir haluros y otros aniones ha sido bien establecida en la literatura. [11] El uso de catalizadores quirales de unión a aniones puede crear un par iónico asimétrico e inducir una estereoselectividad notable.
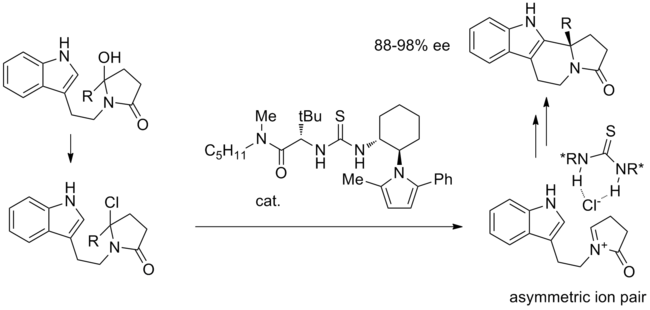
Una de las primeras reacciones propuestas para proceder mediante catálisis de unión aniónica es la ciclación tipo Pictet-Spengler de hidroxilactamas con TMSCl bajo catálisis de tiourea. [12] En el mecanismo propuesto, después de la sustitución inicial del grupo hidroxilo con cloruro, se forma el par iónico clave. El ion iminio activado está estrechamente asociado con el cloruro quiral unido a tiourea y la ciclación intramolecular se produce con alta estereoselectividad.
Los pares de iones asimétricos también pueden verse atacados en reacciones intermoleculares. En un ejemplo interesante, la adición asimétrica de nucleófilos de enol silano a iones de oxocarbenio se puede efectuar formando catalíticamente el oxocarbenio mediante unión aniónica. [13] A partir de un acetal, el cloroéter se genera con tricloruro de boro y se hace reaccionar con el enol silano y el catalizador. El mecanismo de formación del complejo oxocarbenio-tiourea-cloruro no está completamente resuelto. Se cree que, en las condiciones de reacción, el cloroéter puede epimerizarse y la tiourea puede unirse estereoselectivamente al cloruro para formar un par iónico estrechamente asociado. Este par iónico asimétrico es luego atacado por el silano para generar un producto alquilado.

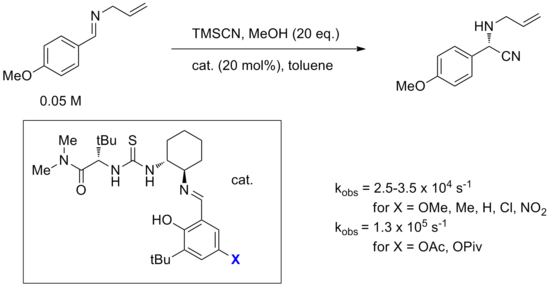
Un ejemplo del mecanismo de unión aniónica es la hidrocianación de iminas catalizada por el catalizador de amido-tiourea de Jacobsen que se muestra en el siguiente diagrama. Esta reacción es también una de las más estudiadas mediante experimentos computacionales, espectroscópicos, de etiquetado y cinéticos. [14] Si bien se consideró la adición directa de cianuro a una imina unida al catalizador, se calculó que un mecanismo alternativo que implica la formación de un par iónico de iminio-cianuro controlado por el catalizador tiene una barrera inferior en 20 kcal/mol. El mecanismo más probable propuesto comienza con la unión del catalizador al HNC, que existe en equilibrio con el HCN . Este complejo luego protona una molécula de imina, formando un par de iones iminio-cianuro con el catalizador uniendo y estabilizando el anión cianuro. Se cree que el iminio también interactúa con la amida carbonilo en la molécula del catalizador (ver catálisis bifuncional a continuación). El anión cianuro unido luego gira y ataca al iminio a través del carbono. Los investigadores concluyen que, aunque la unión de imina-urea se observó mediante espectroscopia y fue respaldada por los primeros experimentos cinéticos, la unión de imina está fuera de ciclo y toda la evidencia apunta hacia que este mecanismo involucra cianuro unido a tiourea.

A menudo es difícil distinguir entre catálisis por enlaces de hidrógeno y catálisis ácida general . [3] Los donantes de enlaces de hidrógeno pueden tener acidez variable, desde ácidos de Brønsted suaves hasta esencialmente fuertes, como los ácidos fosfóricos. Observar el alcance de la transferencia de protones en el transcurso de la reacción es un desafío y no se ha investigado a fondo en la mayoría de las reacciones. Sin embargo, los catalizadores ácidos fuertes a menudo se agrupan con catalizadores de enlace de hidrógeno, ya que representan un extremo en este continuo y sus comportamientos catalíticos comparten similitudes. El mecanismo de activación de estas reacciones implica la protonación inicial de la pareja electrófila. Esto tiene el efecto de hacer que el sustrato sea más electrófilo y crear un par de iones a través del cual es posible transferir información estereoquímica.

La catálisis asimétrica que implica una protonación casi completa del sustrato ha sido eficaz en las reacciones de Mannich de aldiminas aromáticas con nucleófilos de carbono. [15] Además, también se han informado reacciones de aza-Friedel-Crafts de furanos , amidoalquilaciones de compuestos diazocarbonilo, hidrofosfonilación asimétrica de aldiminas e hidrogenaciones de transferencia . [3] Los ácidos quirales de Brønsted a menudo se preparan fácilmente a partir de alcoholes quirales como los BINOL, y muchos ya están presentes en la literatura debido a su utilidad establecida en la investigación de reconocimiento molecular. [dieciséis]
Una de las principales ventajas de la catálisis por puentes de hidrógeno es la capacidad de construir catalizadores que participan en múltiples interacciones no covalentes para promover la reacción. Además de utilizar donantes de enlaces de hidrógeno para activar o estabilizar un centro reactivo durante la reacción, es posible introducir otros grupos funcionales, como bases de Lewis , arenos o sitios de adición de enlaces de hidrógeno para proporcionar una estabilización adicional o influir en los otros. compañero reactivo.
Por ejemplo, la enzima natural corismato mutasa , que cataliza el reordenamiento de Claisen del corismato, presenta muchas otras interacciones además de los enlaces de hidrógeno involucrados en la estabilización del fragmento tipo enolato, que es un ejemplo de la estrategia de estabilización de fragmentos aniónicos discutida anteriormente. [17] Una interacción clave es la estabilización del otro fragmento de alilo catiónico a través de una interacción catión-pi en el estado de transición. El uso de muchos enlaces de hidrógeno adicionales tiene varios propósitos putativos. La estabilización de múltiples enlaces de hidrógeno con la enzima ayuda a superar el costo entrópico de la unión. Además, las interacciones ayudan a mantener el sustrato en una conformación reactiva, y la reacción catalizada por enzimas tiene una entropía de activación cercana a cero, mientras que los reordenamientos típicos de Claisen en solución tienen entropías de activación muy negativas.

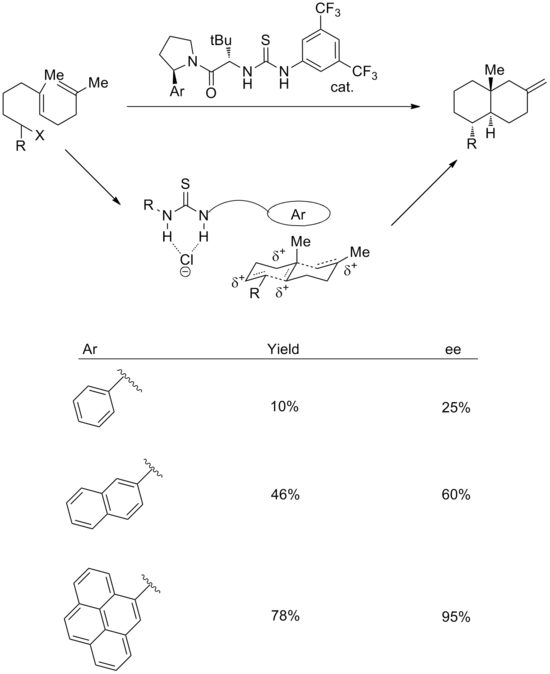
El uso de interacciones catión-pi también se ha implementado en reacciones con catalizadores sintéticos. Se puede utilizar una combinación de estrategias de unión a anión y catión-pi para efectuar policiclizaciones catiónicas enantioselectivas. [18] En el estado de transición, se propone que el grupo tiourea se una al cloruro, mientras que el sistema aromático estabiliza el catión polieno asociado. En apoyo de esto, aumentar el tamaño del anillo aromático conduce a mejoras tanto en el rendimiento como en la estereoselectividad. La enantioselectividad se correlaciona bien tanto con la polarizabilidad como con el momento cuadrupolar del grupo arilo.
Dado que una cantidad tan grande de catalizadores y reacciones implican la unión a electrófilos para estabilizar el estado de transición, muchos catalizadores bifuncionales también presentan un sitio aceptor de enlace de hidrógeno básico de Lewis. Como ejemplo representativo, Deng y sus compañeros de trabajo han desarrollado un catalizador de tiourea-amina capaz de promover reacciones de Michael estereoselectivas. [19] En el estado de transición propuesto, uno de los donantes de tiourea N – H está coordinado con el aceptor de Michael y estabilizará la acumulación de carga negativa. El par solitario de nitrógeno básico actúa como un aceptor de enlaces de hidrógeno para coordinar el nucleófilo, pero en el estado de transición actúa como una base general para promover la adición de enolato nucleófilo.

Este motivo de involucrar tanto a los socios nucleofílicos como electrófilos en una reacción y estabilizarlos en el estado de transición es muy común en la catálisis bifuncional y se pueden encontrar muchos más ejemplos en el artículo sobre organocatálisis de tiourea .
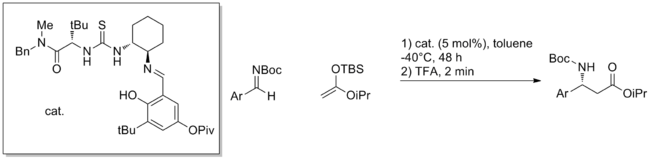
Una estrategia relativamente nueva de utilizar oligopéptidos sintéticos para realizar catálisis ha dado muchos ejemplos de métodos catalíticos. [20] Los péptidos presentan múltiples sitios potenciales para la formación de enlaces de hidrógeno y generalmente no se comprende cómo se unen al sustrato o cómo promueven la reacción. Los péptidos tienen la ventaja de ser extremadamente modulares y, a menudo, estos catalizadores se seleccionan en grandes matrices. De esta manera se han descubierto reacciones altamente enantioselectivas, como la reacción aldólica que se muestra a continuación.
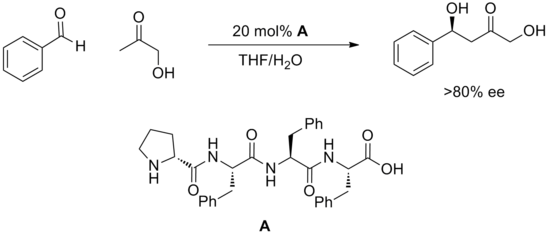
Otras transformaciones catalizadas por péptidos sintéticos incluyen hidrocianación, acilación, adiciones de conjugados, acoplamientos de aldehído-imina, reacción aldólica y bromación. Aunque la naturaleza de los estados de transición no está clara, en muchos ejemplos pequeños cambios en la estructura del catalizador tienen efectos dramáticos sobre la reactividad. Se plantea la hipótesis de que una gran cantidad de enlaces de hidrógeno tanto dentro del péptido como entre el catalizador y el sustrato deben cooperar para cumplir los requisitos geométricos de la catálisis. Más allá de esto, la comprensión del diseño y mecanismo del catalizador aún no ha avanzado más allá de requerir la prueba de bibliotecas de péptidos.
Los tipos de donantes de enlaces de hidrógeno utilizados en la catálisis varían ampliamente de una reacción a otra, incluso entre estrategias catalíticas similares. Si bien los sistemas específicos a menudo se estudian y optimizan ampliamente, existe una gran falta de comprensión general sobre el donante óptimo para una reacción o la relación entre la estructura del catalizador y la reactividad. Todavía no es práctico diseñar racionalmente estructuras para promover una reacción deseada con la selectividad deseada. Sin embargo, la catálisis por puentes de hidrógeno contemporánea se centra principalmente en unos pocos tipos de sistemas que experimentalmente parecen ser eficaces en una variedad de situaciones. [21] Se trata de estructuras denominadas "estructuras privilegiadas". Sin embargo, vale la pena señalar que otros motivos y andamios estructurales también han mostrado resultados prometedores, como los donantes de enlaces de hidrógeno coordinados por metales. [22]
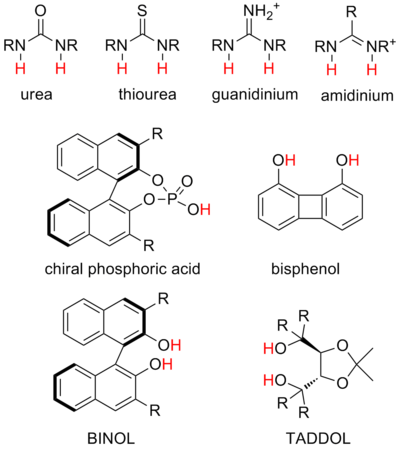

En general, la acidez de los sitios donantes se correlaciona bien con la fuerza del donante. Por ejemplo, es una estrategia común agregar sustituyentes arilo aceptores de electrones en un catalizador de tiourea, lo que puede aumentar su acidez y, por tanto, la fuerza de sus enlaces de hidrógeno. Sin embargo, todavía no está claro cómo se correlaciona la fuerza del donante con la reactividad deseada. Es importante destacar que los catalizadores más ácidos no son necesariamente más eficaces. Por ejemplo, las ureas son menos ácidas que las tioureas en aproximadamente 6 unidades pKa, pero en general no es cierto que las ureas sean significativamente peores a la hora de catalizar reacciones. [28]
Además, rara vez se comprende bien el efecto de los distintos sustituyentes sobre el catalizador. Pequeños cambios de sustituyentes pueden cambiar completamente la reactividad o selectividad. Un ejemplo de esto fueron los estudios de optimización de un catalizador de reacción bifuncional de Strecker, uno de los primeros catalizadores de tiourea bien estudiados. [29] Específicamente, al variar el sustituyente X en el sustituyente salicilaldimina, se encontró que los sustituyentes típicos aceptores o donadores de electrones tenían poco efecto sobre la velocidad, pero los sustituyentes éster como el acetato o el pivaloato parecían causar una notable aceleración de la velocidad. Esta observación es difícil de racionalizar dado que el grupo X está lejos del centro reactivo durante el curso de la reacción y la electrónica no parece ser la causa.
Hasta la fecha, ha habido pocos ejemplos de catálisis por puentes de hidrógeno en la síntesis de productos naturales a pesar de la gran cantidad de reacciones descubiertas. Generalmente, con una alta carga de catalizador requerida y, a menudo, una especificidad de sustrato extrema, la catálisis por enlace de hidrógeno aún no es útil.
En la síntesis de Jacobsen de (+)-yohimbina, [30] un alcaloide indol, una reacción enantioselectiva temprana de Pictet-Spengler utilizando un catalizador de tiourea sustituido con pirrol produjo cantidades de producto en escala de gramos con 94% de ee y 81% de rendimiento. El resto de la síntesis fue corta, utilizando una aminación reductora y una reacción intramolecular de Diels-Alder.

En 2008, Takemoto reveló una síntesis concisa de (-) -epibatidina que se basaba en una cascada de Michael, catalizada por un catalizador bifuncional. [31] Después de la adición inicial asimétrica de Michael al β-nitroestireno , la adición intramolecular de Michael proporciona el producto cetoéster cíclico en 75% ee. Las manipulaciones estándar de grupos funcionales y una ciclación intramolecular producen el producto natural.

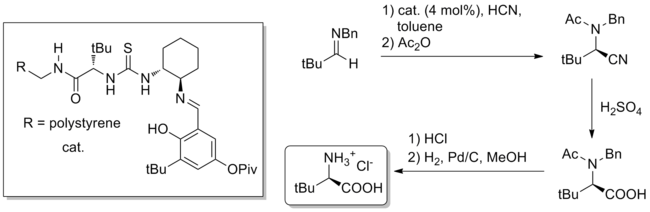
Además de la síntesis total, la catálisis por enlaces de hidrógeno se ha aplicado a la síntesis masiva de moléculas pequeñas quirales de difícil acceso. Un ejemplo es la síntesis de Strecker a escala de gramos de aminoácidos no naturales utilizando catálisis de tiourea, informada en la revista Nature en 2009. [32] El catalizador, ya sea unido a polímero u homogéneo, se deriva de la terc-leucina natural y puede catalizar (4 % en moles de carga de catalizador) la formación del producto de Strecker a partir de benzhidrilaminas y HCN acuoso. La hidrólisis del nitrilo y las desprotecciones producen terc-leucina pura no natural con un rendimiento total del 84% y un ee del 99%.