El hidruro de hierro (I) , sistemáticamente denominado hidruro de hierro y poli (hidridohierro), es un compuesto inorgánico sólido con la fórmula química (FeH)
norte(también escrito ([FeH])
norteo FeH). Es termodinámica y cinéticamente inestable hacia la descomposición a temperatura ambiente y, como tal, se sabe poco sobre sus propiedades generales.
El hidruro de hierro (I) es el hidruro de hierro polimérico más simple. Debido a su inestabilidad, no tiene usos industriales prácticos. Sin embargo, en química metalúrgica , el hidruro de hierro (I) es fundamental para ciertas formas de aleaciones de hierro-hidrógeno .
El nombre sistemático hidruro de hierro , un nombre IUPAC válido , se construye según la nomenclatura composicional. Sin embargo, como el nombre es de naturaleza composicional, no distingue entre compuestos de la misma estequiometría, como especies moleculares, que exhiben propiedades químicas distintas. Los nombres sistemáticos poli(hidridohierro) y poli[ferrano(1)] , también nombres IUPAC válidos, se construyen de acuerdo con las nomenclaturas sustitutiva aditiva y deficiente en electrones, respectivamente. Sí distinguen el compuesto titular de los demás.
El hidridohierro, también denominado sistemáticamente ferrano(1), es un compuesto relacionado con la fórmula química FeH (también escrito [FeH]). También es inestable a temperatura ambiente con la propensión adicional a autopolimerizarse, por lo que no se puede concentrar.
El hidridohierro es el hidruro de hierro molecular más simple. Además, se puede considerar que es el monómero de hidruro de hierro (I). Se ha detectado de forma aislada sólo en ambientes extremos, como atrapado en gases nobles congelados , en la atmósfera de estrellas frías o como gas a temperaturas superiores al punto de ebullición del hierro. Se supone que tiene tres enlaces de valencia colgantes y, por tanto, es un radical libre ; su fórmula puede escribirse FeH 3• para enfatizar este hecho.
A temperaturas muy bajas (por debajo de 10 K ), el FeH puede formar un complejo con el hidrógeno molecular FeH·H 2 . [1]
El hidridohierro fue detectado por primera vez en el laboratorio por B. Kleman y L. Åkerlind en los años cincuenta. [ cita necesaria ]
Un solo electrón de otra especie atómica o molecular puede unirse con el centro de hierro en hidridohierro mediante sustitución:
Debido a esta captura de un solo electrón, el hidridohierro tiene carácter radical . El hidridohierro es un radical fuerte.
Un par de electrones de una base de Lewis puede unirse con el centro de hierro mediante aducción:
Debido a esta captura de un par de electrones aducido , el hidridohierro tiene carácter ácido de Lewis . Cabe esperar que el hidruro de hierro (I) tenga propiedades radicales significativamente disminuidas, pero tenga propiedades ácidas similares; sin embargo, las velocidades de reacción y las constantes de equilibrio son diferentes.
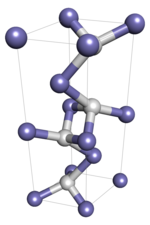
En el hidruro de hierro (I), los átomos forman una red y los átomos individuales están interconectados mediante enlaces covalentes . Dado que es un sólido polimérico, no se espera que una muestra monocristalina experimente transiciones de estado, como fusión y disolución, ya que esto requeriría la reordenación de los enlaces moleculares y, en consecuencia, cambiaría su identidad química. Se espera que las muestras cristalinas coloidales, en las que las fuerzas intermoleculares son relevantes, experimenten transiciones de estado.
El hidruro de hierro (I) adopta una estructura cristalina compacta hexagonal doble con el grupo espacial P6 3 /mmc, también conocido como hidruro de hierro épsilon-prime en el contexto del sistema hierro-hidrógeno. Se predice que exhibirá polimorfismo, pasando a una temperatura inferior a -173 °C (-279 °F) a una estructura cristalina centrada en la cara con el grupo espacial Fm 3 m.
Se predice que FeH tendrá un cuarteto y un sexteto de estados fundamentales.
La molécula de FeH tiene al menos cuatro estados electrónicos de baja energía causados por el electrón no enlazante que toma posiciones en diferentes orbitales: X 4 Δ, a 6 Δ b 6 Π, [2] y c 6 Σ + . [3] Los estados de mayor energía se denominan B 4 Σ − , C 4 Φ, D 4 Σ + , E 4 Π y F 4 Δ. [4] Niveles aún más altos están etiquetados como G 4 Π y H 4 Δ del sistema cuarteto, y d 6 Σ − , e 6 Π, f 6 Δ y g 6 Φ. [2] En los estados del cuarteto, el número cuántico interno J toma los valores 1/2, 3/2, 5/2 y 7/2.
El FeH tiene una importante banda de absorción (llamada banda de Wing-Ford ) en el infrarrojo cercano con un borde de banda en 989,652 nm y una absorción máxima en 991 nm. [5] También tiene líneas en azul de 470 a 502,5 nm y en verde de 520 a 540 nm. [6]
El pequeño desplazamiento isotópico del FeD deuterado en comparación con el FeH en esta longitud de onda muestra que la banda se debe a una transición (0,0) desde el estado fundamental , es decir, F 4 Δ—X 4 Δ. [7]
Existen otras bandas en cada parte del espectro debido a diferentes transiciones vibratorias. [8] La banda (1,0), también debida a las transiciones F 4 Δ—X 4 Δ, está alrededor de 869,0 nm y la banda (2,0) alrededor de 781,8 nm. [4]
Dentro de cada banda hay una gran cantidad de líneas. Estos se deben a la transición entre diferentes estados de rotación. Las líneas se agrupan en subbandas 4 Δ 7/2 — 4 Δ 7/2 (la más fuerte) y 4 Δ 5/2 — 4 Δ 5/2 , 4 Δ 3/2 — 4 Δ 3/2 y 4 Δ 1/2 — 4 Δ 1/2 . Los números como 7/2 son valores para Ω , el componente de giro. [8] Cada uno de estos tiene dos ramas P y R, y algunos tienen una rama Q. Dentro de cada uno hay lo que se llama división Λ que da como resultado líneas de energía más bajas (designadas "a") y líneas de energía más altas (llamadas "b"). Para cada uno de ellos hay una serie de líneas espectrales que dependen de J, el número cuántico rotacional, comenzando desde 3,5 y subiendo en pasos de 1. La altura de J depende de la temperatura. Además hay 12 ramas de satélite 4 Δ 7/2 — 4 Δ 5/2 , 4 Δ 5/2 — 4 Δ 3/2 , 4 Δ 3/2 — 4 Δ 1/2 , 4 Δ 5/2 — 4 Δ 7/2 , 4 Δ 3/2 — 4 Δ 5/2 y 4 Δ 1/2 — 4 Δ 3/2 con ramas P y R. [5]
Algunas líneas son magnéticamente sensibles, como 994,813 y 995,825 nm. Se amplían por el efecto Zeeman y otros en la misma banda son insensibles a campos magnéticos como 994,911 y 995,677 nm. [9] Hay 222 líneas en el espectro de la banda (0-0). [10]
El hidruro de hierro es una de las pocas moléculas que se encuentran en el Sol. [11] En 1972 se informaron líneas para FeH en la parte azul-verde del espectro solar, incluidas muchas líneas de absorción en 1972. [6] También las sombras de manchas solares muestran la banda Wing-Ford de manera prominente. [8]
Las bandas de FeH (y otros hidruros de metales de transición y tierras alcalinas ) aparecen de manera prominente en los espectros de emisión de enanas M y L , el tipo más caliente de enana marrón. Para las enanas T más frías , las bandas de FeH no aparecen, [12] probablemente debido a que las nubes de hierro líquido bloquean la visión de la atmósfera y la eliminan de la fase gaseosa de la atmósfera. En enanas marrones aún más frías (<1350 K), reaparecen señales de FeH, lo que se explica porque las nubes tienen espacios en blanco. [13]
La explicación del tipo de estrellas en las que aparece la banda FeH Wing-Ford es que la temperatura ronda los 3000 K y la presión es suficiente para que se forme una gran cantidad de moléculas de FeH. Una vez que la temperatura alcanza los 4000 K, como en una enana K, la línea es más débil debido a que se disocian más moléculas. En las gigantes rojas M , la presión del gas es demasiado baja para que se forme FeH. [7]
Las galaxias elípticas y lenticulares también tienen una banda de Wing-Ford observable, debido a que gran parte de su luz proviene de enanas M. [8]
En 2021, se confirmó la presencia de rastros de FeH en la atmósfera del caliente Júpiter WASP-79b . [14]
Kleman y Åkerlind produjeron por primera vez FeH en el laboratorio calentando hierro a 2600 K en un horno tipo King bajo una fina atmósfera de hidrógeno.
También se puede obtener FeH molecular (junto con FeH 2 y otras especies) vaporizando hierro en una atmósfera de argón-hidrógeno y congelando el gas sobre una superficie sólida a aproximadamente 10 K (-263 °C ). El compuesto puede detectarse mediante espectroscopia infrarroja , y aproximadamente la mitad desaparece cuando la muestra se calienta brevemente a 30 K. [15] Una técnica variante utiliza una atmósfera de hidrógeno puro condensada a 4 K. [1]
Este procedimiento también genera moléculas que se pensaba que eran FeH 3 (hidruro férrico) pero que luego se asignaron a una asociación de FeH e hidrógeno molecular H 2 . [dieciséis]
El FeH molecular se ha producido mediante la desintegración del 57 Co incrustado en hidrógeno sólido. La espectroscopia de Mössbauer reveló un desplazamiento de isómeros de 0,59 mm/s en comparación con el hierro metálico y una división cuadrupolar de 2,4 mm/s. [17] FeH también se puede producir mediante la interacción del vapor de pentacarbonilo de hierro y el hidrógeno atómico en una descarga de microondas. [18]