La hexafluoroacetona (HFA) es un compuesto químico con la fórmula (CF 3 ) 2 CO. Es estructuralmente similar a la acetona ; sin embargo, su reactividad es marcadamente diferente. Es un gas incoloro, higroscópico, no inflamable y altamente reactivo, caracterizado por un olor a humedad. [2] La forma más común de esta sustancia es sesquihidrato de hexafluoroacetona (1,5 H 2 O) , que es un hemihidrato de hexafluoropropano-2,2-diol (F
3C)
2C(OH)
2, un diol geminal .
La ruta industrial hacia el HFA implica el tratamiento de hexacloroacetona con HF : [3]
El óxido de hexafluoropropileno se reorganiza para dar HFA.
En el laboratorio, el HFA se puede preparar en un proceso de dos pasos a partir de perfluoropropeno. En el primer paso, KF cataliza la reacción del alqueno con azufre elemental para dar el 1,3-ditietano [(CF 3 ) 2 CS] 2 . Esta especie luego se oxida con yodato para dar (CF 3 ) 2 CO. [4]
La hexafluoroacetona se utiliza en la producción de hexafluoroisopropanol :
También se utiliza como precursor del hexafluoroisobutileno , [3] un monómero utilizado en la química de polímeros, y como componente básico en la síntesis de midaflur , bisfenol AF , anhídrido 4,4′-(hexafluoroisopropiliden)diftálico y alitamo .
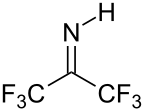
La hexafluoroacetona es un electrófilo . Los nucleófilos atacan al carbono carbonilo . En el agua, la hexafluoroacetona existe predominantemente como hidrato. La constante de equilibrio (K eq ) para la formación de este diol geminal es 10 6 M −1 . El equilibrio análogo para la acetona es desfavorable 10 −3 M −1 . [5] Los hidratos de hexafluoroacetona son ácidos. En una reacción análoga, el amoníaco se agrega a la hexafluoroacetona para dar el hemiaminal (CF 3 ) 2 C(OH)(NH 2 ) que puede deshidratarse con cloruro de fosforilo para dar la imina (CF 3 ) 2 CNH. [6]