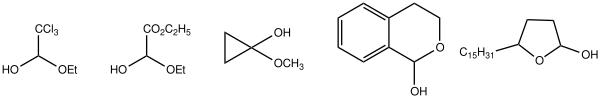
En química orgánica , un hemiacetal o un hemicetal tiene la fórmula general R 1 R 2 C(OH)OR , donde R 1 , R 2 es hidrógeno o un sustituyente orgánico . Generalmente resultan de la adición de un alcohol (un compuesto con al menos un grupo −OH ) a un aldehído ( R−CH=O ) o una cetona ( R 2 C=O ), aunque a estos últimos a veces se les llama hemicetales . La mayoría de los azúcares son hemiacetales.
Según la definición de la IUPAC , en R 1 R 2 C(OH)OR R 1 y R 2 pueden ser o no un hidrógeno. En un hemicetal, ninguno de los grupos R puede ser un hidrógeno. Los hemicetales se consideran hemiacetales donde ninguno de los grupos R es H, y por lo tanto son una subclase de los hemiacetales. [1] El prefijo griego hèmi significa mitad, se refiere al hecho de que se ha añadido un solo alcohol al grupo carbonilo , en contraste con los acetales o cetales , que se forman cuando se ha añadido un segundo grupo alcoxi a la estructura. [2]
Los hemiacetales y hemicetales cíclicos a veces se denominan lactoles . [3] A menudo se forman fácilmente, especialmente cuando son anillos de 5 y 6 miembros. En este caso, un grupo OH intramolecular reacciona con el grupo carbonilo. La glucosa y muchas otras aldosas existen como hemiacetales cíclicos, mientras que la fructosa y cetosas similares existen como hemicetales cíclicos.
Las soluciones de aldehídos simples en alcoholes se componen principalmente de hemiacetal. El equilibrio es fácilmente reversible y dinámico. El equilibrio es sensible a los efectos estéricos. [4]
Se podría decir que los hemiacetales más comunes son los azúcares, por ejemplo la glucosa . La favorabilidad de la formación de un anillo de seis miembros libre de tensión y la electrofilicidad de un aldehído se combinan para favorecer fuertemente la forma acetal.
Los hemiacetales y hemicetales pueden considerarse intermediarios en la reacción entre alcoholes y aldehídos o cetonas, siendo el producto final un acetal o un cetal:
Generalmente la segunda reacción es desfavorable y se produce en presencia de un agente deshidratante.