En las ciencias físicas , una fase es una región de material que es químicamente uniforme, físicamente distinta y (a menudo) mecánicamente separable. En un sistema que consiste en hielo y agua en un frasco de vidrio, los cubitos de hielo son una fase, el agua es una segunda fase y el aire húmedo es una tercera fase sobre el hielo y el agua. El vidrio del frasco es un material diferente, en su propia fase separada. (Véase estado de la materia § Vidrio .)
Más precisamente, una fase es una región del espacio (un sistema termodinámico ), a lo largo de la cual todas las propiedades físicas de un material son esencialmente uniformes. [1] [2] : 86 [3] : 3 Los ejemplos de propiedades físicas incluyen densidad , índice de refracción , magnetización y composición química.
El término fase se utiliza a veces como sinónimo de estado de la materia , pero puede haber varias fases inmiscibles del mismo estado de la materia (como cuando el aceite y el agua se separan en fases distintas, ambas en estado líquido). También se utiliza a veces para referirse a los estados de equilibrio que se muestran en un diagrama de fases , descrito en términos de variables de estado como la presión y la temperatura y delimitados por límites de fase . (Los límites de fase se relacionan con cambios en la organización de la materia, incluido, por ejemplo, un cambio sutil dentro del estado sólido de una estructura cristalina a otra, así como cambios de estado como entre sólido y líquido). Estos dos usos no son proporcionales a la definición formal dada anteriormente y el significado pretendido debe determinarse en parte a partir del contexto en el que se utiliza el término.

Las distintas fases pueden describirse como diferentes estados de la materia, como gas , líquido , sólido , plasma o condensado de Bose-Einstein . Las mesofases útiles entre sólido y líquido forman otros estados de la materia.
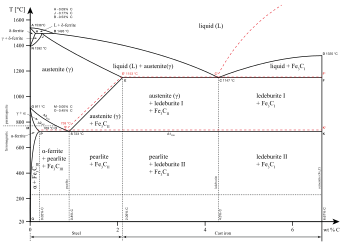
También pueden existir fases distintas dentro de un estado dado de la materia. Como se muestra en el diagrama para las aleaciones de hierro, existen varias fases tanto para el estado sólido como para el líquido. Las fases también se pueden diferenciar en función de la solubilidad , como en polar (hidrófila) o no polar (hidrófoba). Una mezcla de agua (un líquido polar) y aceite (un líquido no polar) se separará espontáneamente en dos fases. El agua tiene una solubilidad muy baja (es insoluble) en aceite, y el aceite tiene una solubilidad baja en agua. La solubilidad es la cantidad máxima de un soluto que puede disolverse en un disolvente antes de que el soluto deje de disolverse y permanezca en una fase separada. Una mezcla puede separarse en más de dos fases líquidas y el concepto de separación de fases se extiende a los sólidos, es decir, los sólidos pueden formar soluciones sólidas o cristalizar en fases cristalinas distintas. Los pares de metales que son mutuamente solubles pueden formar aleaciones , mientras que los pares de metales que son mutuamente insolubles no pueden.
Se han observado hasta ocho fases líquidas inmiscibles . [a] Las fases líquidas mutuamente inmiscibles se forman a partir de agua (fase acuosa), disolventes orgánicos hidrófobos, perfluorocarbonos ( fase fluorada ), siliconas, varios metales diferentes y también a partir de fósforo fundido. No todos los disolventes orgánicos son completamente miscibles, por ejemplo, una mezcla de etilenglicol y tolueno puede separarse en dos fases orgánicas distintas. [b]
Las fases no necesitan separarse macroscópicamente de forma espontánea. Las emulsiones y los coloides son ejemplos de combinaciones de pares de fases inmiscibles que no se separan físicamente.
Si se deja que se equilibren, muchas composiciones formarán una única fase uniforme, pero, según la temperatura y la presión, incluso una sola sustancia puede separarse en dos o más fases distintas. Dentro de cada fase, las propiedades son uniformes, pero entre las dos fases las propiedades difieren.
El agua contenida en un recipiente cerrado con un espacio de aire sobre él forma un sistema de dos fases. La mayor parte del agua se encuentra en la fase líquida, donde se mantiene gracias a la atracción mutua de las moléculas de agua. Incluso en el equilibrio, las moléculas están en constante movimiento y, de vez en cuando, una molécula en la fase líquida gana suficiente energía cinética para separarse de la fase líquida y entrar en la fase gaseosa. Asimismo, de vez en cuando, una molécula de vapor choca con la superficie del líquido y se condensa en el líquido. En el equilibrio, los procesos de evaporación y condensación se equilibran exactamente y no hay un cambio neto en el volumen de ninguna de las fases.
A temperatura y presión ambiente, el recipiente con agua alcanza el equilibrio cuando el aire sobre el agua tiene una humedad de aproximadamente el 3%. Este porcentaje aumenta a medida que aumenta la temperatura. A 100 °C y presión atmosférica, el equilibrio no se alcanza hasta que el aire es 100% agua. Si el líquido se calienta un poco más de 100 °C, el paso de líquido a gas se producirá no solo en la superficie sino en todo el volumen del líquido: el agua hierve.
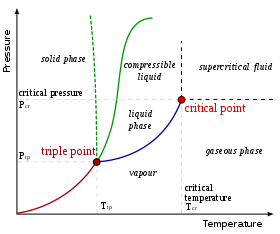
Para una composición dada, solo ciertas fases son posibles a una temperatura y presión determinadas. La cantidad y el tipo de fases que se formarán son difíciles de predecir y, por lo general, se determinan mediante experimentos. Los resultados de dichos experimentos se pueden representar gráficamente en diagramas de fases .
El diagrama de fases que se muestra aquí corresponde a un sistema de un solo componente. En este sistema simple, las fases posibles dependen únicamente de la presión y la temperatura . Las marcas indican los puntos en los que dos o más fases pueden coexistir en equilibrio. A temperaturas y presiones distintas de las marcas, solo habrá una fase en equilibrio.
En el diagrama, la línea azul que marca el límite entre líquido y gas no continúa indefinidamente, sino que termina en un punto llamado punto crítico . A medida que la temperatura y la presión se acercan al punto crítico, las propiedades del líquido y el gas se vuelven progresivamente más similares. En el punto crítico, el líquido y el gas se vuelven indistinguibles. Por encima del punto crítico, ya no hay fases líquidas y gaseosas separadas: solo hay una fase fluida genérica denominada fluido supercrítico . En el agua, el punto crítico se produce alrededor de 647 K (374 °C o 705 °F) y 22,064 MPa .
Una característica inusual del diagrama de fases del agua es que la línea de fase sólida-líquida (ilustrada por la línea verde punteada) tiene una pendiente negativa. Para la mayoría de las sustancias, la pendiente es positiva, como lo ejemplifica la línea verde oscura. Esta característica inusual del agua está relacionada con el hecho de que el hielo tiene una densidad menor que el agua líquida. Al aumentar la presión, el agua pasa a la fase de mayor densidad, lo que provoca la fusión.
Otra característica interesante, aunque no inusual, del diagrama de fases es el punto en el que la línea de la fase sólido-líquido se encuentra con la línea de la fase líquido-gas. La intersección se denomina punto triple . En el punto triple, las tres fases pueden coexistir.
Experimentalmente, las líneas de fase son relativamente fáciles de representar debido a la interdependencia de la temperatura y la presión que se desarrolla cuando se forman múltiples fases. La regla de fases de Gibbs sugiere que las diferentes fases están completamente determinadas por estas variables. Considere un aparato de prueba que consiste en un cilindro cerrado y bien aislado equipado con un pistón. Al controlar la temperatura y la presión, el sistema puede llevarse a cualquier punto en el diagrama de fases. Desde un punto en la región de estabilidad sólida (lado izquierdo del diagrama), el aumento de la temperatura del sistema lo llevaría a la región donde un líquido o un gas es la fase de equilibrio (dependiendo de la presión). Si el pistón se baja lentamente, el sistema trazará una curva de aumento de temperatura y presión dentro de la región de gas del diagrama de fases. En el punto donde el gas comienza a condensarse en líquido, la dirección de la curva de temperatura y presión cambiará abruptamente para trazar a lo largo de la línea de fase hasta que se haya condensado toda el agua.
Entre dos fases en equilibrio hay una región estrecha en la que las propiedades no son las de ninguna de las fases. Aunque esta región puede ser muy delgada, puede tener efectos significativos y fácilmente observables, como hacer que un líquido presente tensión superficial . En las mezclas, algunos componentes pueden moverse preferentemente hacia la interfaz . En términos de modelado, descripción o comprensión del comportamiento de un sistema particular, puede ser eficaz tratar la región interfacial como una fase separada.
Un único material puede tener varios estados sólidos distintos capaces de formar fases separadas. El agua es un ejemplo bien conocido de un material de este tipo. Por ejemplo, el hielo de agua se encuentra habitualmente en la forma hexagonal hielo I h , pero también puede existir como hielo cúbico I c , hielo romboédrico II y muchas otras formas. El polimorfismo es la capacidad de un sólido de existir en más de una forma cristalina. Para los elementos químicos puros, el polimorfismo se conoce como alotropía . Por ejemplo, el diamante , el grafito y los fulerenos son diferentes alótropos del carbono .
Cuando una sustancia experimenta una transición de fase (cambia de un estado de la materia a otro), generalmente absorbe o libera energía. Por ejemplo, cuando el agua se evapora, el aumento de la energía cinética a medida que las moléculas que se evaporan escapan de las fuerzas de atracción del líquido se refleja en una disminución de la temperatura. La energía necesaria para inducir la transición de fase se toma de la energía térmica interna del agua, que enfría el líquido a una temperatura más baja; por lo tanto, la evaporación es útil para enfriar. Véase Entalpía de vaporización . El proceso inverso, la condensación, libera calor. La energía térmica, o entalpía, asociada con una transición de sólido a líquido es la entalpía de fusión y la asociada con una transición de sólido a gas es la entalpía de sublimación .
Si bien las fases de la materia se definen tradicionalmente para sistemas en equilibrio térmico, el trabajo sobre sistemas localizados de muchos cuerpos (MBL) cuánticos ha proporcionado un marco para definir fases fuera del equilibrio. Las fases MBL nunca alcanzan el equilibrio térmico y pueden permitir nuevas formas de orden que no se permiten en el equilibrio a través de un fenómeno conocido como orden cuántico protegido por localización. Las transiciones entre diferentes fases MBL y entre MBL y fases termalizantes son transiciones de fase dinámicas novedosas cuyas propiedades son áreas activas de investigación.