Tumor M2-PK es un sinónimo de la forma dimérica de la isoenzima tipo M2 de la piruvato quinasa ( PKM2 ), una enzima clave en el metabolismo tumoral . Tumor M2-PK puede estar elevada en muchos tipos de tumores, en lugar de ser un marcador tumoral específico de órganos como el PSA . Se están investigando los niveles elevados en heces (fecales) como método de detección de tumores colorrectales , y se están probando los niveles plasmáticos de EDTA para su posible aplicación en el seguimiento de varios tipos de cáncer .
Existen ELISA tipo sándwich basados en dos anticuerpos monoclonales que reconocen específicamente la M2-PK tumoral (la forma dimérica de la M2-PK) para la cuantificación de la M2-PK tumoral en muestras de heces y plasma con EDTA, respectivamente. Como biomarcador , la cantidad de M2-PK tumoral en heces y plasma con EDTA refleja el estado metabólico específico de los tumores.
La M2-PK, medida en heces , es un posible marcador tumoral del cáncer colorrectal . Cuando se mide en heces con un valor de corte de 4 U/ml, su sensibilidad se ha estimado en un 85 % (con un intervalo de confianza del 95 % de 65 a 96 %) para el cáncer de colon y en un 56 % (intervalo de confianza del 41 al 74 %) para el cáncer de recto. [1] Su especificidad es del 95 %. [2]
La prueba M2-PK no depende de sangre oculta ( método ELISA ), por lo que puede detectar cáncer de intestino sangrante o no sangrante y también pólipos con alta sensibilidad y alta especificidad sin falsos negativos, pero pueden ocurrir falsos positivos. [3]
La mayoría de las personas están más dispuestas a aceptar controles médicos preventivos no invasivos. Por lo tanto, la medición de la M2-PK tumoral en muestras de heces, con seguimiento mediante colonoscopia para aclarar los resultados positivos de la M2-PK tumoral, puede resultar un avance en la detección temprana de carcinomas colorrectales. La prueba M2-PK con marcado CE está disponible en forma de prueba ELISA para resultados cuantitativos o como prueba en el punto de atención para recibir los resultados en minutos.
La M2PK tumoral también es útil para diagnosticar el cáncer de pulmón y es mejor que los marcadores tumorales SCC y NSE . [4] En el carcinoma de células renales (RCC), la prueba M2PK tiene una sensibilidad del 66,7 por ciento para el RCC metastásico y del 27,5 por ciento para el RCC no metastásico, pero la prueba M2PK no puede detectar el carcinoma de células transicionales de la vejiga, el cáncer de próstata y la hiperplasia prostática benigna. [5]
Estudios de varios grupos de trabajo internacionales han revelado una cantidad significativamente mayor de Tumor M2-PK en muestras de plasma con EDTA de pacientes con tumores renales, pulmonares, de mama, cervicales y gastrointestinales (esófago, estómago, páncreas, colon, recto), así como melanoma, que se correlacionó con el estadio del tumor .
La combinación de Tumor M2-PK con el marcador tumoral clásico apropiado, como CEA para el cáncer de intestino, CA 19-9 para el cáncer de páncreas y CA 72-4 para el cáncer gástrico, aumenta significativamente la sensibilidad para detectar diversos tipos de cáncer.
Una aplicación importante de la prueba Tumor M2-PK en plasma EDTA es el seguimiento durante la terapia tumoral, para monitorear el éxito o el fracaso del tratamiento elegido, así como para predecir las posibilidades de “cura” y supervivencia.
Si los niveles de M2-PK del tumor disminuyen durante la terapia y luego permanecen bajos después de la misma, esto indica que el tratamiento fue exitoso. Un aumento en los valores de M2-PK del tumor durante o después de la terapia indica una recaída y/o metástasis.
En ocasiones también pueden aparecer valores elevados de M2-PK tumoral en enfermedades inflamatorias graves , que deben excluirse mediante diagnóstico diferencial.
La piruvato quinasa cataliza el último paso de la secuencia glucolítica , la desfosforilación del fosfoenolpiruvato a piruvato, y es responsable de la producción neta de energía dentro de la vía glucolítica. Dependiendo de las diferentes funciones metabólicas de los tejidos, se expresan diferentes isoenzimas de la piruvato quinasa.
La M2-PK ( PKM2 ) es la isoforma predominante de la piruvato quinasa en células proliferantes, como fibroblastos , células embrionarias y células madre adultas y la mayoría de los tejidos humanos, incluidos pulmón, vejiga, riñón y timo; la M2-PK se agrega positivamente en muchos tumores humanos. [6]
La M2-PK puede presentarse en dos formas diferentes en las células proliferantes:
La forma tetramérica de M2-PK tiene una alta afinidad por su sustrato, el fosfoenolpiruvato (PEP), y es muy activa en concentraciones fisiológicas de PEP. Además, la forma tetramérica de M2-PK está asociada con varias otras enzimas glucolíticas dentro del llamado complejo enzimático glucolítico . Debido a la proximidad de las enzimas, la asociación dentro del complejo enzimático glucolítico conduce a una conversión altamente efectiva de glucosa en lactato. Cuando M2-PK está principalmente en la forma tetramérica altamente activa, que es el caso en la mayoría de las células normales, la glucosa se convierte principalmente en lactato, con la producción concomitante de energía.
Por el contrario, la forma dimérica de M2-PK tiene una baja afinidad por el fosfoenolpiruvato, siendo casi inactiva a concentraciones fisiológicas de PEP. Cuando M2-PK está principalmente en la forma dimérica, que es el caso de las células tumorales, todos los fosfometabolitos por encima de la piruvato quinasa se acumulan y se canalizan hacia procesos sintéticos que se ramifican a partir de intermediarios glucolíticos, como ácidos nucleicos , fosfolípidos y aminoácidos , importantes bloques de construcción celulares para células altamente proliferantes como las células tumorales.
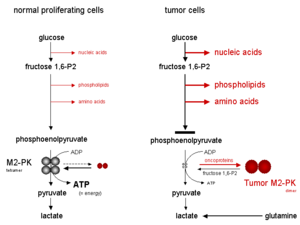
Como consecuencia de la posición clave de la piruvato quinasa dentro de la glucólisis, la relación tetrámero:dímero de M2-PK determina si los carbonos de la glucosa se convierten en piruvato y lactato, junto con la producción de energía (forma tetramérica), o se canalizan hacia procesos sintéticos (forma dimérica). En las células tumorales, M2-PK se encuentra principalmente en forma dimérica. Por lo tanto, la forma dimérica de M2-PK se ha denominado M2-PK tumoral .
La dimerización de M2-PK en células tumorales es inducida por la interacción directa de M2-PK con diferentes oncoproteínas .
Sin embargo, la relación tetrámero:dímero de M2-PK no es constante.
La falta de oxígeno o la alta acumulación de intermediarios glucolíticos, como la fructosa 1,6-bisfosfato (fructosa 1,6-P2) o el aminoácido serina, inducen la reasociación de la forma dimérica de M2-PK a la forma tetramérica. En consecuencia, debido a la activación de M2-PK, la glucosa se convierte en piruvato y lactato bajo la producción de energía hasta que los niveles de fructosa 1,6-P2 caen por debajo de un cierto valor umbral, lo que permite la disociación de la forma tetramérica de M2-PK a la forma dimérica. A partir de entonces, el ciclo de oscilación comienza de nuevo cuando los niveles de fructosa 1,6-P2 alcanzan un cierto valor umbral superior que induce la tetramerización de M2-PK.
Cuando la M2-PK está principalmente en la forma dimérica menos activa, la energía se produce mediante la degradación del aminoácido glutamina a aspartato, piruvato y lactato, lo que se denomina glutaminólisis .
En las células tumorales, el aumento de la tasa de producción de lactato en presencia de oxígeno se denomina efecto Warburg .
Por primera vez se reportó la enzima piruvato quinasa M2 con dos mutaciones sin sentido, H391Y y K422R, encontradas en células de pacientes con síndrome de Bloom , propensos a desarrollar cáncer. Los resultados muestran que a pesar de la presencia de mutaciones en el dominio de contacto entre subunidades, las proteínas mutantes K422R y H391Y mantuvieron su estructura homotetramérica, similar a la proteína de tipo salvaje, pero mostraron una pérdida de actividad del 75 y 20%, respectivamente. H391Y mostró un aumento de 6 veces en la afinidad por su sustrato fosfoenolpiruvato y se comportó como una proteína no alostérica con unión cooperativa comprometida. Sin embargo, la afinidad por el fosfoenolpiruvato se perdió significativamente en K422R. A diferencia de K422R, H391Y mostró una estabilidad térmica mejorada, estabilidad en un rango de valores de pH, un efecto menor del inhibidor alostérico Phe y resistencia a la alteración estructural tras la unión del activador (fructosa 1,6-bisfosfato) y el inhibidor (Phe). Ambos mutantes mostraron un ligero cambio en el pH óptimo de 7,4 a 7,0. [7] La coexpresión de PKM2 de tipo salvaje homotetramérico y mutante en el medio celular que resultó en la interacción entre los dos a nivel de monómero se corroboró aún más mediante experimentos in vitro. La interacción entre monómeros alteró significativamente el estado oligomérico de PKM2 al favorecer la dimerización y la heterotetramerización. El estudio in silico proporcionó un respaldo adicional al demostrar que la heterooligomerización era energéticamente favorable. Las poblaciones hetero-oligoméricas de PKM2 mostraron una actividad y afinidad alteradas, y su expresión resultó en un aumento de la tasa de crecimiento de Escherichia coli , así como de células de mamíferos, junto con un aumento de la tasa de poliploidía. Se sabe que estas características son esenciales para la progresión tumoral. [8]
[9]
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace )