En química , un experimento cruzado es un método utilizado para estudiar el mecanismo de una reacción química . En un experimento cruzado, dos reactivos similares pero distinguibles experimentan simultáneamente una reacción como parte de la misma mezcla de reacción. Los productos formados corresponderán directamente a uno de los dos reactivos (productos no cruzados) o incluirán componentes de ambos reactivos (productos cruzados). El objetivo de un experimento cruzado es determinar si un proceso de reacción implica o no una etapa en la que los componentes de cada reactivo tienen la oportunidad de intercambiarse entre sí.
Los resultados de los experimentos cruzados suelen ser sencillos de analizar, lo que los convierte en uno de los métodos de estudio mecanicista más útiles y aplicados con mayor frecuencia. En química orgánica , los experimentos cruzados se utilizan con mayor frecuencia para distinguir entre reacciones intramoleculares e intermoleculares . [1] [2] [3] Los químicos inorgánicos y organometálicos dependen en gran medida de experimentos cruzados, y en particular de experimentos de etiquetado isotópico , para respaldar o contradecir los mecanismos propuestos. [4] Cuando el mecanismo que se investiga es más complicado que una sustitución o reordenamiento intra o intermolecular, el diseño del experimento cruzado puede convertirse en sí mismo en una cuestión desafiante. [5] Un experimento cruzado bien diseñado puede llevar a conclusiones sobre un mecanismo que de otro modo sería imposible de realizar. Muchos estudios mecanicistas incluyen tanto experimentos cruzados como mediciones de la velocidad y los efectos isotópicos cinéticos .
Los experimentos cruzados permiten el estudio experimental de un mecanismo de reacción. Los estudios mecanicistas son de interés para los químicos teóricos y experimentales por una variedad de razones, incluida la predicción de resultados estereoquímicos , la optimización de las condiciones de reacción para la velocidad y la selectividad, y el diseño de catalizadores mejorados para un mejor número de rotación, robustez, etc. [6] [7] Dado que un mecanismo no se puede observar directamente ni determinar únicamente basándose en los reactivos o productos, los mecanismos son difíciles de estudiar experimentalmente. Sólo un puñado de métodos experimentales son capaces de proporcionar información sobre el mecanismo de una reacción, incluidos experimentos cruzados, estudios del efecto isotópico cinético y variaciones de velocidad por sustituyente. El experimento cruzado tiene la ventaja de ser conceptualmente sencillo y relativamente fácil de diseñar, realizar e interpretar. En los estudios mecanicistas modernos, los experimentos cruzados y los estudios KIE se utilizan comúnmente junto con métodos computacionales . [8]
El concepto subyacente al experimento cruzado es básico: siempre que el método de etiquetado elegido no afecte la forma en que se desarrolla la reacción, un cambio en el etiquetado observado en los productos puede atribuirse al mecanismo de reacción. Por lo tanto, la limitación más importante en el diseño de experimentos cruzados es que el etiquetado no afecta el mecanismo de reacción en sí. [1]
Puede resultar difícil saber si los cambios realizados en los reactivos para un experimento cruzado afectarán o no el mecanismo por el cual se desarrolla la reacción. Esto es particularmente cierto ya que el objetivo del experimento cruzado es proporcionar información sobre el mecanismo que permitiría este tipo de predicciones. Siempre existe la posibilidad de que una etiqueta altere el curso de la reacción. [1]
En la práctica, los experimentos cruzados pretenden utilizar el menor cambio posible entre las condiciones habituales de la reacción que se estudia y las condiciones del experimento cruzado. Este principio favorece el marcaje isotópico, ya que cambiar el isótopo de un átomo en una molécula es el cambio más pequeño que puede realizarse y rastrearse fácilmente en la reacción. Si el isótopo se coloca en la molécula en una posición directamente involucrada en el mecanismo de la reacción, se espera un efecto isotópico cinético. Esto se puede utilizar para estudiar aspectos del mecanismo de forma independiente o junto con un experimento cruzado. [1] [2] [8] El efecto isotópico cinético es un cambio en la velocidad de reacción basado en el cambio de isótopo, no un cambio en el mecanismo de la reacción en sí, por lo que el marcaje isotópico generalmente satisface los requisitos para un cruce válido. experimento. En experimentos cruzados que no utilizan marcaje isotópico, normalmente se espera que la adición o resta de un sustituyente metilo en una posición que no participa en ningún mecanismo propuesto para la reacción dé como resultado un experimento cruzado válido. [1]
Al diseñar un experimento cruzado, la primera tarea es proponer posibles mecanismos para la reacción que se está estudiando. Con base en estos posibles mecanismos, el objetivo es determinar un experimento cruzado tradicional o un experimento de codificación de isótopos que permitirá al investigador distinguir entre los dos o más mecanismos posibles. A menudo será necesario emplear muchos métodos de estudio mecanicista para respaldar o descartar todos los mecanismos propuestos. Sin embargo, en algunos casos, un experimento cruzado por sí solo podrá distinguir entre las principales posibilidades, por ejemplo en el caso de mecanismos de reacción orgánica intramolecular e intermolecular.
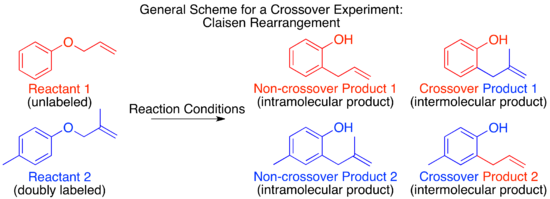
El mecanismo del reordenamiento térmico de Claisen se ha estudiado mediante experimento cruzado y sirve como un excelente ejemplo de cómo aplicar esta técnica. [9] Antes de que se determinara el mecanismo, se propuso que la reacción podría proceder por vía intermolecular o intramolecular. [1]

Al observar estos dos mecanismos propuestos, está claro que un experimento cruzado será adecuado para distinguirlos, como suele ser el caso de los mecanismos intermoleculares e intramoleculares. El siguiente paso en el diseño de experimentos cruzados es proponer reactivos marcados. Para un método de marcaje no isotópico, la perturbación más pequeña del sistema será la adición de un grupo metilo en una posición no reactiva.
Predecir los productos dados por cada mecanismo mostrará si un diseño de experimento cruzado determinado puede distinguir entre los mecanismos en cuestión. Esto es particularmente relevante cuando se emplea una etiqueta isotópica. Es posible que el etiquetado en una posición pueda distinguir entre sólo dos de varios mecanismos posibles, mientras que colocar la etiqueta isotópica en una posición diferente pueda distinguir entre tres mecanismos potenciales o proporcionar información sobre estados de transición o intermediarios, etc. Una vez establecido el valor interpretativo Es relevante considerar los aspectos prácticos, como si es posible o no la síntesis del reactivo propuesto, y qué tan fácil o difícil es distinguir los productos predichos para cada mecanismo propuesto y materiales de partida.
Para el reordenamiento de Claisen, el marcaje mediante la adición de un único grupo metilo produce un sistema poco marcado. El experimento cruzado resultante no sería útil como estudio mecanicista ya que los productos de un mecanismo intermolecular o intramolecular son idénticos.
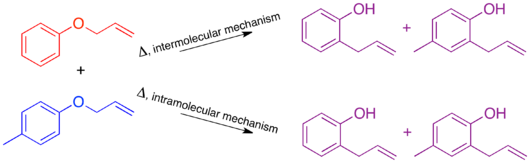
Para tener un sistema suficientemente marcado, ambas “mitades” de la molécula que se separarían en un mecanismo intermolecular deben estar marcadas. Esto se conoce como sistema doblemente etiquetado y generalmente es el requisito para un experimento cruzado. [1] La predicción de los productos de cada mecanismo muestra que los productos cruzados son distintos de los productos no cruzados. Una vez establecido esto y predichos los productos, se puede realizar el experimento y caracterizar los productos. Cuando se utiliza el etiquetado isotópico, los productos suelen ser más variados y la distribución de la etiqueta más complicada. En este caso, también es importante predecir explícitamente las cantidades relativas de etiqueta que se espera que aparezcan en cada posición dependiendo del mecanismo.

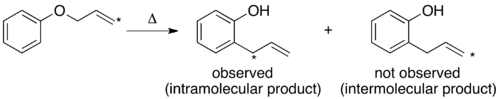
Cuando se lleva a cabo el experimento de cruce en el reordenamiento de Claisen solo se observan productos que no se cruzan. En base a esto, se determina que el mecanismo es intramolecular, como se muestra en el mecanismo estándar de empuje de flechas para este reordenamiento. [1] [10]
Un experimento de etiquetado isotópico es un experimento utilizado en un estudio mecanicista que emplea isótopos como etiquetas y rastrea estas etiquetas en los productos. Los experimentos de etiquetado isotópico se consideran comúnmente como un tipo de experimento cruzado. [1] Sin embargo, hay muchas más posibilidades para la forma de etiquetado y los productos potenciales en un experimento de etiquetado isotópico que en un experimento cruzado tradicional. La clasificación de un experimento de etiquetado isotópico como un experimento cruzado se basa en el concepto subyacente, el objetivo y los principios de diseño similares en los dos experimentos en lugar de en una similitud directa. Se puede diseñar un experimento de etiquetado isotópico para que sea directamente análogo a un experimento cruzado tradicional, pero hay muchas formas adicionales de llevar a cabo experimentos de etiquetado isotópico.
Aunque los experimentos de marcaje isotópico tienen la ventaja de utilizar la mínima perturbación en el sistema de reacción, están limitados por la posibilidad de intercambio isotópico con disolvente u otras especies presentes en la mezcla de reacción. Si el marcador isotópico se intercambia con otro isótopo del mismo átomo en el disolvente, los resultados de un experimento de marcado isotópico no se pueden utilizar. Esto limita el uso del marcaje con deuterio en determinadas posiciones en disolventes próticos, por ejemplo. Sin embargo, este intercambio puede resultar útil al investigar la interacción con el disolvente de una reacción, ya que el marcaje isotópico puede detectar esta interacción.
Se han llevado a cabo experimentos de etiquetado isotópico en el reordenamiento térmico de Claisen. Cuando el carbono terminal está etiquetado con 14 C, solo hay un producto, apareciendo la etiqueta isotópica en la posición bencílico. Dado que no se observa el producto esperado de un mecanismo intermolecular, la conclusión coincide con la del experimento de cruce tradicional. [1] [10]
Una ventaja importante del experimento cruzado es que los resultados del experimento se obtienen mediante la caracterización directa del producto. Las técnicas implicadas son, por tanto, las que el químico experimental ya conoce. La espectrometría de masas y la espectroscopia de RMN son las dos formas más comunes de determinar los productos y sus proporciones relativas. La espectroscopia de RMN es particularmente útil para estudios de etiquetado isotópico que utilizan isótopos de hidrógeno o carbono.
La espectroscopia IR puede ser útil en situaciones especializadas, como cuando se usó 13CO para investigar el mecanismo de inserción de alquilo en enlaces metal-monóxido de carbono para formar complejos metal-acilo . El seguimiento del 13 CO en los productos se logró mediante espectroscopía IR porque la mayor masa de 13 C en comparación con 12 C produce un cambio distintivo de la frecuencia de estiramiento de ν (CO) a una energía más baja. [4]
Los productos que se esperan de cualquier mecanismo determinado se determinan durante el diseño del experimento cruzado. Esto puede ser bastante complicado de establecer, pero permite una interpretación sencilla de los resultados. Si los productos observados coinciden con los predichos por un mecanismo determinado, entonces es razonable concluir que ese mecanismo está operando en la reacción. Si los resultados no coinciden con ninguna distribución esperada, es necesario considerar mecanismos alternativos y/o la posibilidad de que el etiquetado haya afectado la forma en que se desarrolla la reacción.
Para los experimentos cruzados utilizados para distinguir entre reacciones intermoleculares e intramoleculares, la ausencia de productos cruzados es menos concluyente que la presencia de productos cruzados. Esto se debe a que los efectos de la jaula del disolvente podrían estar enmascarando un mecanismo intermolecular. [ 15]
Los experimentos cruzados tienen varias limitaciones. Aunque son útiles para distinguir entre los mecanismos de reacción propuestos, su capacidad para proporcionar información sobre un mecanismo más allá de lo que ya se ha propuesto es limitada. El diseño de un experimento cruzado útil se basa en tener un mecanismo propuesto en el cual basar las predicciones de la distribución de etiquetas en los productos. Si los resultados no coinciden con ningún resultado esperado, el mecanismo real no es obvio a partir de los resultados del experimento cruzado. Una limitación adicional es, por supuesto, que algunos sistemas simplemente no son adecuados para experimentos cruzados. Este podría ser el caso si la adición de un marcador altera el mecanismo o detiene la reacción por completo, si no hay un mecanismo propuesto, si los marcadores isotópicos se intercambian con moléculas de disolvente o si no es factible sintetizar las especies marcadas necesarias para un experimento cruzado. .
Una de las principales limitaciones del experimento cruzado es que no puede descartar la posibilidad de que los efectos de la jaula del disolvente estén enmascarando un mecanismo de disociación. Si se observan productos cruzados, la evidencia de que el mecanismo no puede ser puramente intramolecular es concluyente. Sin embargo, la falta de productos cruzados no es una prueba concluyente de que el mecanismo sea únicamente intramolecular. Siempre que la reacción se lleve a cabo en disolvente, siempre es posible que los efectos de jaula del disolvente impidan la formación de productos cruzados. [ 15]
Cuando una molécula se disuelve en un disolvente, es apropiado considerar que el disolvente crea una "jaula" alrededor de la molécula. La cantidad de tiempo que le toma a una determinada molécula “escapar” de esta jaula de solvente varía con el tamaño de la molécula y la intensidad de las fuerzas intermoleculares del solvente, pero se considera que es del orden de 1 x 10 −10 segundos. [11] Si una reacción ocurre más rápido de lo que las moléculas pueden escapar de la jaula del solvente, entonces solo se observarán productos sin cruce, enmascarando el verdadero mecanismo de reacción. [5]
Cuando la escala de tiempo de la reacción es mucho más lenta que la escala de tiempo del efecto de jaula del disolvente, las especies disociadas pueden escapar de la jaula del disolvente y formar productos cruzados. Esta es una representación apropiada de una reacción en un experimento cruzado que ocurre mediante un mecanismo intermolecular y forma productos cruzados como se esperaba.
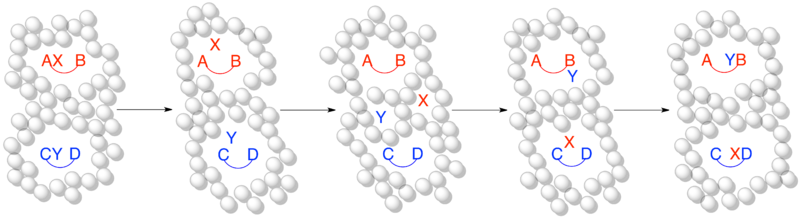
Cuando la escala de tiempo de la reacción es más rápida o en el mismo orden que la escala de tiempo del efecto jaula del disolvente, esta es una representación más precisa del mismo experimento cruzado anterior. Aunque se produce un mecanismo disociativo o intermolecular, no se produce ningún cruce porque la escala de tiempo de la reacción es lo suficientemente corta como para que el fragmento disociado permanezca atrapado dentro de la jaula del disolvente.
El efecto de la jaula de disolvente en los experimentos cruzados no es un concepto puramente teórico. Una de las primeras pruebas experimentales de la existencia de la jaula de disolvente fue la observación del efecto de la jaula de disolvente en un experimento cruzado. Dado que las recombinaciones de radicales ocurren en escalas de tiempo muy cortas en comparación con las reacciones no radicales, el efecto de jaula de disolvente es particularmente relevante para la química de radicales . [5] Lyons y Levy fueron los primeros en demostrar el efecto de la jaula de disolvente en un experimento de cruce radical. Cuando se combinan protio y deuteroazometano y se irradian en fase gaseosa, el resultado es una mezcla estadística de los productos de recombinación de radicales cruzados y no cruzados esperados, C 2 H 6 , CH 3 CD 3 y C 2 D 6 . como 1:2:1. [12]

Sin embargo, cuando se lleva a cabo la misma reacción en una solución de isooctano, la cantidad de CH 3 CD 3 formada asciende a menos del 0,3% de la cantidad total de C 2 H 6 formada. [12] [13] Esto demostró que el efecto jaula de disolvente es capaz de alterar significativamente los resultados de un experimento cruzado, especialmente en reacciones de corta escala, como aquellas que involucran radicales.
La primera prueba de restricción endocíclica fue un experimento cruzado publicado por Albert Eschenmoser en 1970. Se sabía que ocurrían reacciones de metilación en las que un anión sulfonilo actúa como nucleófilo y un metilo (arenosulfonato) sirve como electrófilo, pero se propuso que podrían continuar. ya sea intermolecular o intramolecularmente. [2]

La reacción simultánea de los aniones protio y deuterosulfonilo doblemente marcados en un experimento cruzado dio una mezcla 1:1:1:1 de productos cruzados y no cruzados, lo que indica claramente que la reacción se desarrolla a través de un mecanismo intermolecular. Este resultado fue sorprendente, ya que el mecanismo intramolecular procedería a través de un estado de transición cíclico parecido a un anillo de seis miembros, que se sabe que es un estado de transición favorecido en muchos mecanismos orgánicos. El hecho de que esta reacción se desarrolle a través de un mecanismo intermolecular y no intramolecular lleva a la conclusión de que existen ciertas restricciones en la geometría del ataque nucleofílico en las reacciones S N 2. [2] [14] Las restricciones estereoelectriónicas fueron racionalizadas en el conjunto de las Reglas de Baldwin . Este concepto se ha explorado más a fondo en muchas pruebas de restricción endocíclica posteriores. [15]

Los mecanismos de la química inorgánica y organometálica suelen ser complicados y difíciles de determinar experimentalmente. Los mecanismos catalíticos son particularmente difíciles de estudiar en los casos en los que no se puede aislar ningún complejo metálico aparte del precatalizador. En la edición temática de 2013 de Dalton Transactions titulada “Química organometálica mecanística”, el editor invitado Robert H. Crabtree relata una historia en la que a mediados del siglo XX el fundador de la química del hidruro de carbonilo metálico se refería a los mecanismos organometálicos como “filosofía química”. [8] El número temático continúa presentando diecisiete ejemplos de estudios mecanicistas modernos de reacciones organometálicas. En muchos casos, se utilizan en conjunto experimentos cruzados, experimentos de codificación de isótopos, efectos de isótopos cinéticos y estudios computacionales para aclarar incluso algunos aspectos de un mecanismo organometálico.
Los experimentos de cruce proporcionan una visión tan singularmente útil de los mecanismos inorgánicos que en ocasiones se emplean isótopos inusuales para un experimento de cruce esencial. En el trabajo de EL Muetterties sobre dirhenio decacarbonilo, se llevó a cabo un experimento cruzado utilizando 185 Re y 187 Re para determinar el mecanismo de las reacciones de sustitución de los dímeros de renio carbonilo. Se utilizó espectrometría de masas para distinguir entre estos isótopos en los productos. En el mismo estudio, también se llevaron a cabo experimentos cruzados utilizando 13 CO y 12 CO. [16] El enriquecimiento isotópico a partir de una distribución isotópica inicial de 63 Cu y 65 Cu se estudió en experimentos cruzados de isótopos realizados recientemente por VV Fokin en cobre(I )-cicloadiciones catalizadas por azida-alquino. Los resultados de estos experimentos llevan a la conclusión de que el ciclo catalítico de esta importante reacción de clic implica un intermedio de cobre dinuclear. [17]
La eliminación reductora es un paso común en los mecanismos de reacción organometálicos, y particularmente en los ciclos catalíticos . En los ciclos catalíticos que forman enlaces CH o CC, la eliminación reductiva suele ser el paso final de formación del producto. [18] Los complejos metálicos cuadrados planos d 8 son a menudo los catalizadores activos en las reacciones de formación de enlaces CH o CC, y la eliminación reductiva de estas especies se comprende bien. Existen varios mecanismos conocidos para la eliminación reductiva de complejos planos cuadrados d 8 . En un mecanismo disociativo, un ligando se disocia y se produce una eliminación reductiva a partir de un intermediario de tres coordenadas. En un mecanismo no disociativo, la eliminación reductiva se produce a partir del propio complejo plano cuadrado. Los ligandos que se someten a eliminación reductiva deben estar en cis entre sí o, de lo contrario, deben reorganizarse para ser cis antes de que puedan eliminarse de forma reductiva. Finalmente, en un mecanismo asociativo se asocia un quinto ligando y se produce una eliminación reductiva entre dos grupos adyacentes en el complejo piramidal cuadrado resultante. [4]
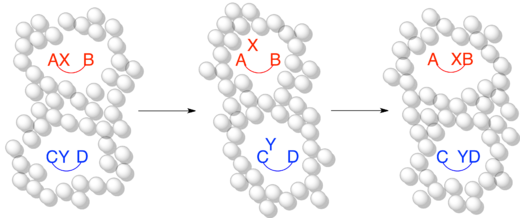
Independientemente del mecanismo específico, siempre es cierto que la eliminación reductora es un proceso intramolecular que acopla dos ligandos adyacentes. Aunque esto pueda parecer ahora obvio, cuando se estudiaron por primera vez los mecanismos organometálicos no había pruebas de estas restricciones. Una serie de experimentos cruzados informados por J. Stille estuvieron entre los primeros experimentos en demostrar que la eliminación reductiva es un proceso intramolecular y que los grupos no adyacentes no eliminan reductivamente. [4] [19] [20] En el estudio se utilizaron varias especies de paladio d 8 planas cuadradas, cada una de las cuales tenía dos ligandos de fosfina unidos y dos grupos metilo unidos. Un complejo, Pd(dppe)(CH3 ) 2 , quedó bloqueado en una confirmación cis mediante la fosfina quelante 1,2-bis(difenilfosfino)etano (dppe). Un segundo complejo, Pd(transfos)(CH 3 ) 2 fue bloqueado en una confirmación trans por "transfos", una fosfina quelante con un conector aromático rígido. [19]
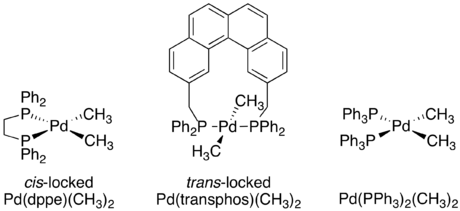
Ya se sabía que los complejos con grupos cis -metilo experimentaban eliminación reductora para formar etano. Se realizó un experimento cruzado tanto en Pd(dppe)(CH3 ) 2 como en Pd( PPh3 ) 2 ( CH3 ) 2 . En ambos casos no se observaron productos cruzados, lo que demuestra la naturaleza intramolecular de la eliminación reductora. [19]
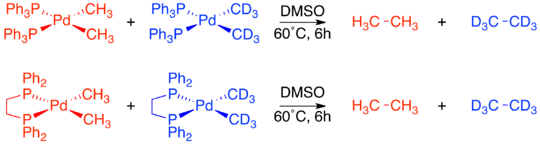
A diferencia de los dos complejos de confirmación cis , el Pd(transfos)(CH 3 ) 2 no experimentó eliminación reductora incluso cuando se calentó a 100 °C. Sin embargo, la adición de yoduro de metilo a Pd(transfos)(CH 3 ) 2 produjo inmediatamente etano. Para determinar si esta eliminación reductora también estaba restringida únicamente a ligandos adyacentes, se llevó a cabo un experimento de marcaje isotópico. El único producto fue el producto de eliminación cis marcado con deuterio . Esto llevó a la conclusión final de que sólo los ligandos adyacentes entre sí en un complejo metálico son capaces de eliminarse de forma reductiva. [4] [19]

Este estudio también rastreó y analizó datos de velocidad de reacción, lo que demuestra el valor de emplear múltiples estrategias en un esfuerzo concertado para obtener la mayor cantidad de información posible sobre un proceso químico. Entre otros experimentos de velocidad, se siguieron las velocidades de reacción de la isomería cis -trans como disolvente y se varió la concentración del exceso de ligando de fosfina. Estos resultados se utilizaron para establecer un mecanismo para esta isomerización en especies de paladio d 8 planas cuadradas que consiste en una asociación de solvente o fosfina seguida de pseudorotación y posterior disociación del solvente o fosfina. [19]
Los mecanismos de las reacciones catalizadas por enzimas también se pueden estudiar mediante experimentos cruzados. Ejemplos de la aplicación de esta técnica en bioquímica incluyen el estudio de reacciones catalizadas por nucleósidos difosfohexosa-4,6-deshidratasas, la eliminación de agua del citrato catalizada por aconitasa y diversas reacciones catalizadas por enzimas dependientes de coenzima B 12 , entre otras. A diferencia de los estudios de etiquetado de isótopos en química orgánica y organometálica, que normalmente utilizan deuterio cuando se desea un isótopo de hidrógeno, los experimentos bioquímicos cruzados emplean con frecuencia tritio . [21] Esto se debe al hecho de que el tritio es radiactivo y se puede rastrear utilizando las autorradiografías de geles en electroforesis en gel .
Los experimentos de etiquetado de isótopos y los experimentos cruzados fueron esenciales para los primeros esfuerzos por comprender el mecanismo de acción de la aconitasa . IA Rose y EL O'Connell llevaron a cabo experimentos de codificación de isótopos utilizando tritio, deuterio y 18 O en la reacción de aconitasa hidratasa. [22] Utilizando los resultados de estos experimentos fue posible construir un mecanismo general para la reacción. Se han realizado más trabajos para perfeccionar este mecanismo desde estos primeros experimentos. [23] [24]
Uno de esos experimentos de codificación de isótopos fue la reacción de citrato [2 R - 3 H] con aconitasa en presencia de cis - aconitato de 2-metilo. Esta reacción produjo tanto cis -aconitato como isocitrato de 2-metil-[3-3H ] sin marcar. La capacidad de la reacción para producir transferencia intermolecular de tritio en esta posición indica que el protón eliminado del citrato no se intercambia con el disolvente. Un experimento similar en el que se hizo reaccionar isocitrato de [2-18 OH ] con aconitasa no logró producir citrato isotópicamente marcado, lo que demuestra que el grupo hidroxilo, a diferencia del protón eliminado, se intercambia con el disolvente en cada recambio. [21] [22]
