La expansión del anillo de Buchner es una reacción orgánica de dos pasos que forma enlaces CC y que se utiliza para obtener anillos de siete miembros . El primer paso implica la formación de un carbeno a partir de diazoacetato de etilo , que ciclopropana un anillo aromático . La expansión del anillo se produce en el segundo paso, con una reacción electrocíclica que abre el anillo de ciclopropano para formar el anillo de siete miembros.

La reacción de expansión del anillo de Buchner fue utilizada por primera vez en 1885 por Eduard Buchner y Theodor Curtius [1] [2] quienes prepararon un carbeno a partir de diazoacetato de etilo para su adición a benceno utilizando vías térmicas y fotoquímicas en la síntesis de derivados de cicloheptatrieno . El producto resultante fue una mezcla de cuatro ácidos carboxílicos isoméricos . Las variaciones en la reacción surgen de los métodos de preparación de carbeno. Los avances en la química organometálica han dado como resultado una mayor selectividad de los derivados de cicloheptatrieno. En la década de 1980 se descubrió que los catalizadores de dirodio proporcionan isómeros de ciclopropano simples en altos rendimientos. [3] Se encuentran aplicaciones en medicina (síntesis de fármacos) [4] [5] [6] [7] [8] y ciencia de los materiales (derivados de fulereno). [9] [10] [11]
La primera síntesis de derivados de cicloheptatrieno de Buchner en 1885 utilizó fotólisis y condiciones térmicas para generar el carbeno. En Organic Syntheses se encuentra disponible un procedimiento para la preparación del material de partida peligroso necesario para la generación de carbeno en la reacción de Buchner, el diazoacetato de etilo . [12] En el procedimiento proporcionado, Searle incluye instrucciones de precaución debido a la naturaleza altamente explosiva de los ésteres diazoacéticos.
La síntesis del carbeno en la década de 1960 se centró en el uso de catalizadores de cobre para la ciclopropanación estereoselectiva . [13] En la década de 1980, se han utilizado catalizadores de dirodio para generar el carbenoide para la ciclopropanación. El advenimiento de la metaloquímica ha mejorado la selectividad de las proporciones de productos de los derivados del ciclohexatrieno mediante la elección del ligando en el catalizador del carbenoide. [14]
El mecanismo de reacción de una expansión de anillo de Buchner comienza con la formación de carbeno a partir de diazoacetato de etilo generado inicialmente a través de reacciones fotoquímicas o térmicas con extrusión de nitrógeno.
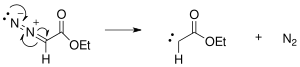
El carbeno generado se agrega a uno de los enlaces dobles del benceno para formar el anillo de ciclopropano.
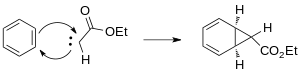
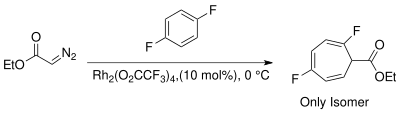
La aparición de reactivos catalizados con metales de transición proporciona métodos estereoespecíficos alternativos para la ciclopropanación. Las opciones para los metales incluyen Cu, Rh y Ru con una variedad de ligandos. [13] El uso de catalizadores de rodio en la reacción de Buchner para la generación de carbeno reduce la cantidad de productos al producir predominantemente los ésteres de cicloheptatrienilo cinéticos. [14] Las mezclas de productos de las reacciones de Buchner resultantes de los catalizadores térmicos de rodio II son menos complicadas. Wyatt et al. han estudiado la regioselectividad de la reacción térmica de Buchner utilizando Rh 2 (O 2 CCF 3 ) 4 y han demostrado que el carácter electrofílico del carbeno de rodio prefiere la reacción en los enlaces π más nucleofílicos del anillo aromático. [15]
El ciclo catalítico aceptado del carbeno [16] fue propuesto por Yates [17] en 1952. Inicialmente, el compuesto diazo se agrega oxidativamente al complejo de ligando metálico. Después de la extrusión de nitrógeno, se genera el carbeno metálico y reacciona con una sustancia aromática rica en electrones para regenerar reductivamente el catalizador metálico y completar así el ciclo catalítico.

El segundo paso de la reacción de Buchner implica una expansión concertada pericíclica del anillo. Según las reglas de Woodward-Hoffmann , la apertura electrocíclica de los derivados del norcaradieno es un proceso disrotatorio de 6 electrones (π 4 s + σ 2 s ), permitido térmicamente.

El equilibrio norcaradieno-cicloheptatrieno se ha estudiado ampliamente. [18] La posición del equilibrio depende de efectos estéricos , electrónicos y conformacionales . Debido a la tensión conformacional en el anillo de ciclopropano del norcaradieno, el equilibrio se encuentra del lado del cicloheptatrieno. El equilibrio puede desplazarse hacia el norcaradieno por desestabilización del cicloheptatrieno por sustitución voluminosa (grupos grandes impedidos estéricamente, es decir, t -butilo) en C1 y C6.

El equilibrio puede alterarse variando la sustitución en C7. Los grupos donadores de electrones (EDG) favorecen al norcaradieno, mientras que los grupos atractores de electrones (EWG) favorecen al cicloheptatrieno.
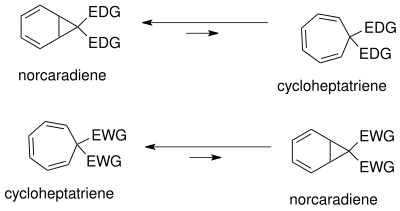
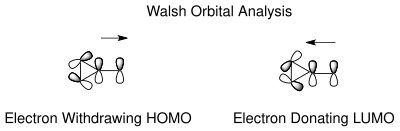
El tautomerismo del norcaradieno y del cicloheptatrieno se puede entender basándose en los orbitales moleculares de Walsh del ciclopropano del anillo de norcaradieno. La racionalización electrónica para la estabilización de los orbitales de Walsh [18] es posible tanto para los grupos que extraen electrones como para los que los donan en el carbono C7. Los orbitales moleculares de los grupos que extraen electrones en C7 se superponen con los orbitales de Walsh del HOMO del anillo de ciclopropano, lo que provoca un acortamiento del enlace C1-C6. En el caso de los grupos que donan electrones, la superposición de orbitales es posible de nuevo ahora en el LUMO, lo que da como resultado un aumento del carácter antienlazante que desestabiliza el tautómero de norcaradieno. La posición del equilibrio se puede controlar dependiendo de los sustituyentes del carbeno.
La importancia de la química de anulación por expansión del anillo de Buchner es evidente en la aplicación de esta secuencia sintética en la síntesis de compuestos biológicos.
Mientras estudiaban una reacción análoga de adición de carbeno al tiofeno , Stephen Matlin y Lam Chan aplicaron el método de expansión del anillo de Buchner en 1981 para generar derivados espiro de la penicilina. [7]

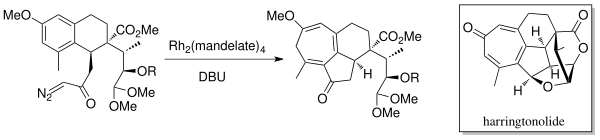
En 1998, Mander et al. sintetizaron el tropón diterpenoide, harringtonolida [6] , utilizando la química de anulación por expansión de anillo intramolecular de Buchner. Se utilizó un catalizador de rodio (Rh 2 (mandelato) 4 ) y DBU (1,8-diazabiciclo[5.4.0]undec-7-eno) para generar el carbeno. Se descubrió que este producto natural tenía propiedades antineoplásicas y antivirales.
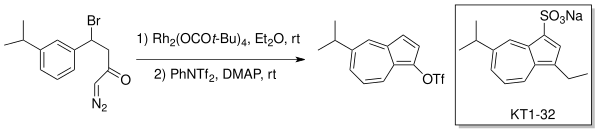
Danheiser et al. utilizaron la generación intramolecular de carbenoides para producir azulenos sustituidos a través de una expansión de anillo de tipo Buchner. El fármaco antiulceroso, Egualen (KT1-32) [4] [5] se sintetizó utilizando esta estrategia de expansión de anillo-anulación con un catalizador de rodio (Rh 2 (OCOt-Bu) 4 ) en éter.
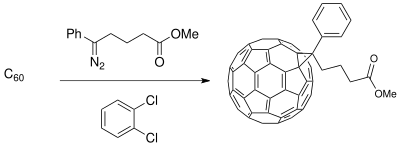
El método de expansión de anillo de Buchner se ha utilizado para sintetizar materiales de partida para aplicaciones en la ciencia de los materiales que involucran células fotovoltaicas . El desarrollo de una interfaz donante-aceptor (DA) compuesta por donantes de polímeros conductores y aceptores derivados de buckminsterfullereno crea un compuesto separado en fases que mejora la fotoconductividad (disponible solo con donantes de polímeros) en el proceso de transferencia de carga fotoinducida de las células fotovoltaicas. [19] Los compuestos de fulereno se pueden funcionalizar para la miscibilidad de C 60 para aumentar la eficiencia de la célula solar dependiendo de la película delgada polimérica sintetizada. [11]
Las desventajas de la reacción involucran reacciones secundarias de la fracción carbeno. La elección del solvente para la reacción debe ser considerada. Además del potencial de reacciones de inserción de enlaces carbono-hidrógeno , la inserción de carbeno carbono-halógeno es posible cuando se utiliza diclorometano como solvente. [20]

Es necesario controlar la regioselectividad durante la adición de carbeno para evitar la aparición de productos secundarios a partir de isómeros de cicloheptatrieno conjugados . Noels et al. utilizaron catalizadores de Rh(II) para la generación de carbeno en condiciones de reacción suaves (temperatura ambiente) para obtener de forma regioselectiva el isómero de cicloheptatrieno no conjugado cinético. [3] [8] [21]
