Un ensayo de unión de ligando ( LBA ) es un ensayo , o un procedimiento analítico, que se basa en la unión de moléculas de ligando a receptores , anticuerpos u otras macromoléculas . [1] Se utiliza un método de detección para determinar la presencia y la cantidad de complejos ligando-receptor formados, y esto generalmente se determina electroquímicamente o mediante un método de detección de fluorescencia . [2] Este tipo de prueba analítica se puede utilizar para probar la presencia de moléculas objetivo en una muestra que se sabe que se unen al receptor. [3]
Existen numerosos tipos de ensayos de unión de ligandos, tanto radiactivos como no radiactivos. [4] [5] [6] Algunos tipos más nuevos se denominan ensayos de "mezcla y medición" porque requieren menos pasos para completarse, por ejemplo, prescindiendo de la eliminación de reactivos no unidos. [5]
Los ensayos de unión de ligandos se utilizan principalmente en farmacología para diversas demandas. Específicamente, a pesar de los receptores endógenos del cuerpo humano , hormonas y otros neurotransmisores , los farmacólogos utilizan ensayos para crear medicamentos que sean selectivos o imiten los componentes celulares encontrados endógenamente. Por otro lado, estas técnicas también están disponibles para crear antagonistas de receptores con el fin de prevenir futuras cascadas. [7] Estos avances brindan a los investigadores la capacidad no solo de cuantificar hormonas y receptores hormonales, sino también de contribuir con información farmacológica importante en el desarrollo de medicamentos y planes de tratamiento. [8]
Históricamente, las técnicas de ensayo de unión de ligando se han utilizado ampliamente para cuantificar las concentraciones de hormonas o receptores de hormonas en plasma o en tejido. La metodología de ensayo de unión de ligando cuantifica la concentración de la hormona en el material de prueba comparando los efectos de la muestra de prueba con los resultados de cantidades variables de proteína conocida ( ligando ).
Las bases sobre las que se han construido los ensayos de unión de ligando son el resultado de Karl Landsteiner , en 1945, y su trabajo sobre la inmunización de animales a través de la producción de anticuerpos para ciertas proteínas. [9] El trabajo de Landsteiner demostró que la tecnología de inmunoensayo permitió a los investigadores analizar a nivel molecular. El primer ensayo de unión de ligando exitoso fue informado en 1960 por Rosalyn Sussman Yalow y Solomon Berson . [9] Investigaron la interacción de unión de la insulina y un anticuerpo específico de insulina, además de desarrollar el primer radioinmunoensayo (RIA) para la insulina. Estos descubrimientos proporcionaron información valiosa sobre la sensibilidad y la especificidad de las hormonas proteicas que se encuentran en los fluidos a base de sangre. [9] Yalow y Berson recibieron el Premio Nobel de Medicina como resultado de sus avances. A través del desarrollo de la tecnología RIA, los investigadores han podido ir más allá del uso de la radiactividad y, en su lugar, utilizar ensayos competitivos, inmunorradiométricos y de fase líquida y sólida. [9] Como resultado directo de estos hallazgos monumentales, los investigadores han continuado el avance de los ensayos de unión de ligandos en muchas facetas en los campos de la biología, la química y similares. Por ejemplo, el laboratorio Lois en Caltech está utilizando ligandos y receptores artificiales diseñados en neuronas para rastrear el flujo de información en el cerebro. [10] Están utilizando específicamente la proteólisis intramembrana inducida por ligando para desentrañar el cableado del cerebro en Drosophila y otros modelos. [11] Cuando el ligando artificial en una neurona se une al receptor en otra, la expresión de GFP se activa en la neurona aceptora, lo que demuestra la utilidad de los ensayos de unión de ligandos en la neurociencia y la biología. [12]
Los ensayos de unión de ligandos proporcionan una medida de las interacciones que ocurren entre dos moléculas, como las uniones de proteínas, así como el grado de afinidad (conexión débil, fuerte o nula) por la cual los reactivos se unen. [13] Los aspectos esenciales de los ensayos de unión incluyen, entre otros, el nivel de concentración de reactivos o productos (consulte la sección sobre radiactividad), el mantenimiento de la constante de equilibrio de los reactivos durante todo el ensayo y la confiabilidad y validez de las reacciones vinculadas. [13] Aunque los ensayos de unión son simples, no brindan información sobre si el compuesto que se está probando afecta o no la función del objetivo. [14]
Los radioligandos se utilizan para medir la unión del ligando a los receptores y, idealmente, deberían tener alta afinidad, baja unión no específica, alta actividad específica para detectar bajas densidades de receptores y especificidad del receptor. [7]
Los niveles de radiactividad de un radioligando (por mol) se denominan actividad específica (SA), que se mide en Ci/mmol. [15] La concentración real de un radioligando está determinada por la mezcla madre específica de la que se originó el radioligando (de los fabricantes). [15] La siguiente ecuación determina la concentración real:
[15]
El análisis de saturación se utiliza en varios tipos de tejidos, como fracciones de plasma parcialmente purificado de homogeneizados de tejido , células transfectadas con receptores clonados y células que están en cultivo o aisladas antes del análisis. [7] El análisis de unión de saturación puede determinar la afinidad y la densidad del receptor. Requiere que la concentración elegida se determine empíricamente para un nuevo ligando.
Hay dos estrategias comunes que se adoptan para este tipo de experimento: [7] aumentar la cantidad de radioligando agregado mientras se mantiene constante la actividad específica y la concentración constante de radioligando, o disminuir la actividad específica del radioligando debido a la adición de un ligando no marcado. [7]
Se puede utilizar un gráfico de Scatchard (gráfico de Rosenthal) para mostrar la afinidad del radioligando. En este tipo de gráfico, la relación entre el radioligando unido y el radioligando libre se representa gráficamente frente al radioligando unido. La pendiente de la línea es igual al recíproco negativo de la constante de afinidad (K). La intersección de la línea con el eje X es una estimación de Bmax. [7] El gráfico de Scatchard se puede estandarizar frente a una referencia adecuada para que pueda haber una comparación directa de la densidad del receptor en diferentes estudios y tejidos. [7] Este gráfico de muestra indica que el radioligando se une con una única afinidad. Si el ligando se hubiera unido a múltiples sitios que tienen diferentes afinidades de radioligando, entonces el gráfico de Scatchard habría mostrado una línea cóncava en su lugar. [7]
Los programas de ajuste de curvas no lineales, como Equilibrium Binding Data Analysis (EBDA) y LIGAND, se utilizan para calcular estimaciones de parámetros de enlace a partir de experimentos de saturación y de enlace competitivo. [16] EBDA realiza el análisis inicial, que convierte la radiactividad medida en concentraciones molares y crea pendientes de Hill y transformaciones de Scatchard a partir de los datos. El análisis realizado por EBDA puede luego ser utilizado por LIGAND para estimar un modelo específico para el enlace. [16]
La unión competitiva se utiliza para determinar la presencia de selectividad para un ligando particular para los subtipos de receptores, lo que permite la determinación de la densidad y proporción de cada subtipo en el tejido. [7] Las curvas de competencia se obtienen trazando la unión específica, que es el porcentaje de la unión total, contra la concentración logarítmica del ligando competidor. [7] Una curva de competencia pronunciada suele ser indicativa de la unión a una única población de receptores, mientras que una curva poco profunda, o una curva con puntos de inflexión claros, es indicativa de múltiples poblaciones de sitios de unión. [16]
A pesar de las diferentes técnicas utilizadas para los ensayos no radiactivos, se requiere que los ligandos presenten características de unión similares a las de su equivalente radiactivo. Por lo tanto, los resultados tanto en ensayos no radiactivos como radiactivos se mantendrán constantes. [5] Una de las mayores diferencias entre los ensayos de ligandos radiactivos y no radiactivos se refiere a los peligros para la salud humana. Los ensayos radiactivos son perjudiciales porque producen residuos radiactivos, mientras que los ensayos de ligandos no radiactivos utilizan un método diferente para evitar la producción de residuos tóxicos. Estos métodos incluyen, entre otros, la polarización de fluorescencia (FP), la transferencia de energía por resonancia de fluorescencia (FRET) y la resonancia de plasmón superficial (SPR). Para medir el proceso de unión ligando-receptor, la mayoría de los métodos no radiactivos requieren que el etiquetado evite interferir con las interacciones moleculares. [5]
La polarización de fluorescencia (FP) es sinónimo de anisotropía de fluorescencia . Este método mide el cambio en la velocidad de rotación de un ligando marcado con fluorescencia una vez que se une al receptor. [5] Se utiliza luz polarizada para excitar el ligando y se mide la cantidad de luz emitida. [5] La despolarización de la luz emitida depende de que el ligando esté unido (por ejemplo, al receptor). Si el ligando no está unido, tendrá una gran despolarización (el ligando es libre de girar rápidamente, haciendo girar la luz). Si el ligando está unido, el mayor tamaño combinado da como resultado una rotación más lenta y, por lo tanto, una despolarización reducida. [5] Una ventaja de este método es que solo requiere un paso de marcado. Sin embargo, este método es menos preciso a bajas concentraciones nanomolares . [5]
El ensayo de exclusión cinética (KinExA) mide el ligando libre (no unido) o el receptor libre presente en una mezcla de ligando, receptor y complejo ligando-receptor. Las mediciones permiten cuantificar la concentración de ligando activo y las constantes de unión (equilibrio, tasas de activación y desactivación) de la interacción. [17]

La transferencia de energía por resonancia de fluorescencia (FRET) utiliza energía transferida entre las moléculas donadoras y aceptoras que están muy próximas. [5] La FRET utiliza un ligando marcado con fluorescencia, como con FP. [5] La transferencia de energía dentro de la FRET comienza excitando al donador. [5] La interacción dipolo-dipolo entre la molécula donadora y aceptora transfiere la energía del donador a la molécula aceptora. [5] Si el ligando está unido al complejo receptor-anticuerpo, entonces el aceptor emitirá luz. [5] Cuando se utiliza FRET, es fundamental que haya una distancia menor a 10 nm entre el aceptor y el donador, además de un espectro de absorción superpuesto entre el aceptor y el donador, y que el anticuerpo no interfiera ni bloquee el sitio de unión del ligando. [5]
.jpg/440px-Surface_Plasmon_Resonance_(SPR).jpg)
La resonancia de plasmón superficial (SPR) no requiere el etiquetado del ligando. [5] En cambio, funciona midiendo el cambio en el ángulo en el que la luz polarizada se refleja desde una superficie ( índice de refracción ). [5] El ángulo está relacionado con el cambio en la masa o el espesor de la capa, como la inmovilización de un ligando que cambia el ángulo de resonancia, lo que aumenta la luz reflejada. [5] El dispositivo para el que se deriva la SPR incluye un chip sensor, una celda de flujo, una fuente de luz, un prisma y un detector de posición de ángulo fijo. [5]
El ensayo de unión de ligando en fase líquida de inmunoprecipitación (IP) es un método que se utiliza para purificar o enriquecer una proteína específica, o un grupo de proteínas, utilizando un anticuerpo de una mezcla compleja. El extracto de tejido o células alteradas se mezcla con un anticuerpo contra el antígeno de interés, lo que produce el complejo antígeno-anticuerpo. [18] Cuando la concentración de antígeno es baja, la precipitación del complejo antígeno-anticuerpo puede tardar horas o incluso días y se vuelve difícil aislar la pequeña cantidad de precipitado formado. [18]
El ensayo inmunoabsorbente ligado a enzimas ( ELISA ) o el Western blot son dos formas diferentes de obtener y analizar el antígeno purificado (o múltiples antígenos). Este método implica la purificación de un antígeno mediante la ayuda de un anticuerpo adherido a un soporte sólido (en forma de perlas), como la resina de agarosa. [19] La inmovilización del complejo proteico se puede lograr en un solo paso o de forma sucesiva. [19]
La IP también se puede utilizar junto con el marcaje de radioisótopos biosintéticos. Mediante esta combinación de técnicas, se puede determinar si un antígeno específico es sintetizado por un tejido o por una célula. [18]

Las placas multipocillos son múltiples placas de Petri incorporadas en un recipiente, con un número de pocillos individuales que varía de 6 a más de 1536. Los ensayos con placas multipocillos son convenientes para manejar las dosis y réplicas necesarias. [20] Existe una amplia gama de tipos de placas que tienen un tamaño estandarizado, equipo de soporte y sistemas de medición. [20] Los electrodos se pueden integrar en la parte inferior de las placas para capturar información como resultado de los ensayos de unión. [9] Los reactivos de unión se inmovilizan en la superficie del electrodo y luego se pueden analizar. [9]
Las placas multipocillos se fabrican para permitir a los investigadores crear y manipular diferentes tipos de ensayos (es decir, bioensayos , inmunoensayos , etc.) dentro de cada placa multipocillo. [20] Debido a la variabilidad en el formato de las placas multipocillos, no es raro que surjan artefactos. Los artefactos se deben a los diferentes entornos que se encuentran dentro de los diferentes pocillos de la placa, especialmente cerca de los bordes y el centro de los pocillos. Dichos efectos se conocen como efectos de pocillo, efectos de borde y efectos de placa. Por lo tanto, se enfatiza la necesidad de colocar los diseños de ensayo de la manera correcta tanto dentro como entre cada placa. [20]
El uso de placas multipocillo es común cuando se mide la actividad de ensayos biológicos in vitro o se mide la inmunorreactividad a través de inmunoensayos. [20] Los artefactos se pueden evitar manteniendo la uniformidad de la placa aplicando la misma dosis del medio específico en cada pocillo, además de mantener la presión atmosférica y las tasas de temperatura para reducir la humedad. [20]
Los ensayos de unión de ligandos en perlas son métodos de aislamiento para proteínas básicas, ADN/ARN u otras biomoléculas ubicadas en suspensiones indefinidas y se pueden utilizar en múltiples aplicaciones biocromatográficas. Los ligandos bioafines se unen covalentemente a perlas de sílice con grupos silanol con carga negativa terminal o perlas de poliestireno y se utilizan para el aislamiento y la purificación de proteínas básicas o la adsorción de biomoléculas. Después de la unión, la separación se realiza por centrifugación (separación por densidad) o por atracción de campo magnético (solo para partículas magnéticas). Las perlas se pueden lavar para proporcionar pureza a la molécula aislada antes de disolverla por métodos de intercambio iónico. Se pueden utilizar métodos de análisis directo basados en detección enzimática/fluorescente (por ejemplo, HRP, tinte fluorescente) para la determinación en perlas o la cuantificación de biomoléculas unidas. [21] [22] [23]
Los ensayos de filtrado son ensayos de unión de ligandos en fase sólida que utilizan filtros para medir la afinidad entre dos moléculas. En un ensayo de unión de filtros , los filtros se utilizan para atrapar las membranas celulares succionando el medio a través de ellas. [8] Este método rápido se produce a una velocidad rápida en la que se puede lograr la filtración y la recuperación de la fracción encontrada. [24] El lavado de filtros con un tampón elimina los ligandos no unidos residuales y cualquier otro ligando presente que sea capaz de ser lavado de los sitios de unión. [8] Los complejos receptor-ligando presentes mientras se lava el filtro no se disociarán significativamente porque quedarán completamente atrapados por los filtros. [8] Las características del filtro son importantes para cada trabajo que se realice. Un filtro más grueso es útil para obtener una recuperación más completa de pequeños trozos de membrana, pero puede requerir un tiempo de lavado más prolongado. [8] Se recomienda pretratar los filtros para ayudar a atrapar los trozos de membrana cargados negativamente. [8] Remojar el filtro en una solución que le daría al filtro una carga superficial positiva atraería los fragmentos de membrana cargados negativamente. [8]
En este tipo de ensayo se sigue la unión de un ligando a las células a lo largo del tiempo. La señal obtenida es proporcional al número de ligandos unidos a una estructura diana, a menudo un receptor, en la superficie celular. La información sobre la interacción ligando-diana se obtiene a partir del cambio de señal a lo largo del tiempo y se pueden calcular parámetros cinéticos como la constante de velocidad de asociación k a , la constante de velocidad de disociación k d y la afinidad K D. [25] Al medir la interacción directamente en las células, no se necesita aislar la proteína diana, lo que de otro modo puede ser un desafío, especialmente para algunas proteínas de membrana. [26] Para garantizar que se mide la interacción con la estructura diana prevista, se recomiendan controles biológicos apropiados, como células que no expresen la estructura diana.
Se han utilizado mediciones en tiempo real utilizando enfoques basados en etiquetas o sin etiquetas para analizar interacciones biomoleculares en células fijadas o vivas. [27] [28]
La ventaja de medir las interacciones ligando-receptor en tiempo real es que no es necesario alcanzar el equilibrio de unión para una determinación precisa de la afinidad. [29]
Los efectos de un fármaco son el resultado de su selectividad de unión con las propiedades de las macromoléculas de un organismo, o la afinidad con la que diferentes ligandos se unen a un sustrato. [30] Más específicamente, la especificidad y selectividad de un ligando a su respectivo receptor proporciona a los investigadores la oportunidad de aislar y producir efectos específicos de los fármacos mediante la manipulación de las concentraciones de ligando y las densidades de receptores. [30] Las hormonas y los neurotransmisores son ligandos reguladores endógenos esenciales que afectan a los receptores fisiológicos dentro de un organismo. [30] Los fármacos que actúan sobre estos receptores son increíblemente selectivos para producir las respuestas requeridas de las moléculas de señalización. [30]
La unión específica se refiere a la unión de un ligando a un receptor, y es posible que exista más de un sitio de unión específico para un ligando. [31] La unión no específica se refiere a la unión de un ligando a algo distinto de su receptor designado, como varios otros receptores o diferentes tipos de transportadores en la membrana celular. [31] Por ejemplo, varios antagonistas pueden unirse a múltiples tipos de receptores. En el caso de los antagonistas muscarínicos, también pueden unirse a los receptores de histamina. [31] Dichos patrones de unión se consideran técnicamente específicos, ya que el destino del ligando es específico para múltiples receptores. Sin embargo, los investigadores pueden no centrarse en tales comportamientos en comparación con otros factores de unión. [31] Sin embargo, el comportamiento de unión no específica es una información muy importante que se debe adquirir. Estas estimaciones se miden examinando cómo un ligando se une a un receptor mientras reacciona simultáneamente a un agente sustituto (antagonista) que evitará que se produzca la unión específica. [31]
Tipos de unión específicos a interacciones de ligando y receptor: [30]
Las tecnologías para el ensayo de unión de ligandos continúan avanzando en relación con el aumento de la velocidad y el mantenimiento de procedimientos rentables al mismo tiempo que se mantiene y aumenta la precisión y la sensibilidad. [9] Algunos avances tecnológicos incluyen nuevos reactivos de unión como alternativas a los anticuerpos, [9] soluciones de colorantes alternativas y sistemas de microplacas, y el desarrollo de un método para omitir el paso de filtración, que se requiere en muchos procesos de ensayo de unión de ligandos. [16]
Una molécula de señalización importante en las células es el calcio (Ca 2+ ), que se puede detectar con un colorante de acetoximetilo Fluo-4 . Se une a los iones Ca 2+ libres , que a su vez aumentan ligeramente la fluorescencia del AM Fluo-4. [16] El inconveniente de la formulación del colorante Fluo-4 es que se requiere un paso de lavado para eliminar el colorante extracelular, que puede proporcionar señales de fondo no deseadas. Por ejemplo, el lavado pone estrés adicional en las células, así como consume tiempo, lo que impide un análisis oportuno. [16] Recientemente, se ha desarrollado una solución de colorante alternativa y un sistema de microplaca llamado FLIPR® (lector de placas de imágenes fluorométricas), que utiliza un reactivo de ensayo de calcio 3 que no requiere un paso de lavado. Como resultado, el cambio en la fluorescencia del colorante se puede ver en tiempo real sin demora utilizando un láser excitador y un dispositivo acoplado a la carga . [16]
Muchos ensayos de unión de ligandos requieren un paso de filtración para separar los ligandos unidos de los no unidos antes del cribado. Recientemente se ha desarrollado un método llamado ensayo de proximidad de centelleo (SPA), que elimina este paso, que de otro modo sería crucial. Funciona a través de perlas de red cristalina, que están recubiertas con moléculas de acoplamiento de ligando y llenas de iones de cerio . Estas emiten ráfagas de luz cuando son estimuladas por un isótopo, que se puede medir fácilmente. Los ligandos se radiomarcan utilizando 3H o 125I y se liberan en el ensayo. Dado que solo los radioligandos que se unen directamente a las perlas inician una señal, los ligandos libres no interfieren durante el proceso de cribado. [16]
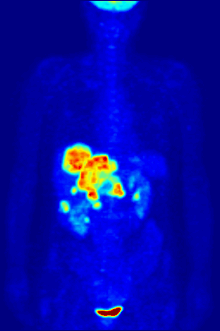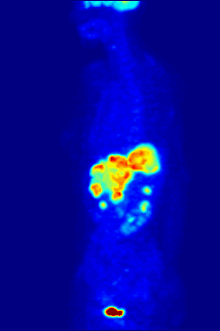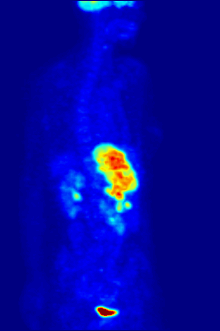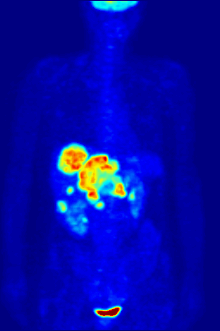
Por naturaleza, los ensayos deben realizarse en un entorno controlado in vitro, por lo que este método no proporciona información sobre la unión al receptor in vivo. Los resultados obtenidos solo pueden verificar que un ligando específico se adapta a un receptor, pero los ensayos no proporcionan ninguna forma de conocer la distribución de los receptores de unión al ligando en un organismo.
La unión de ligandos y la distribución de receptores in vivo se pueden estudiar mediante la tomografía por emisión de positrones (PET), que funciona mediante la inducción de un radionúclido en un ligando, que luego se libera en el cuerpo de un organismo estudiado. Los ligandos radiomarcados se ubican espacialmente mediante un escáner PET para revelar áreas en el organismo con altas concentraciones de receptores. [16]