
El tratamiento de gases con aminas , también conocido como depuración de aminas , endulzamiento de gases y eliminación de gases ácidos , se refiere a un grupo de procesos que utilizan soluciones acuosas de varias alquilaminas (comúnmente denominadas simplemente aminas ) para eliminar el sulfuro de hidrógeno (H2S ) y el dióxido de carbono (CO2 ) de los gases. [1] [2] [3] Es un proceso unitario común utilizado en refinerías , y también se utiliza en plantas petroquímicas , plantas de procesamiento de gas natural y otras industrias.
Los procesos que se llevan a cabo en refinerías de petróleo o plantas de procesamiento químico que eliminan el sulfuro de hidrógeno se denominan procesos de "endulzamiento" porque el olor de los productos procesados mejora gracias a la ausencia de sulfuro de hidrógeno "agrio". Una alternativa al uso de aminas es la tecnología de membranas . Sin embargo, la separación por membranas es menos atractiva debido a los costos operativos y de capital relativamente altos, así como a otros factores técnicos. [4]
En el tratamiento de gases se utilizan muchas aminas diferentes:
Las aminas más utilizadas en las plantas industriales son las alcanolaminas DEA, MEA y MDEA. Estas aminas también se utilizan en muchas refinerías de petróleo para eliminar los gases ácidos de los hidrocarburos líquidos, como el gas licuado de petróleo (GLP).
Los gases que contienen H 2 S o tanto H 2 S como CO 2 se denominan comúnmente gases agrios o gases ácidos en las industrias de procesamiento de hidrocarburos .
La química involucrada en el tratamiento con aminas de dichos gases varía un poco según la amina particular que se utilice. Para una de las aminas más comunes, la monoetanolamina (MEA), denominada RNH 2 , la reacción ácido-base que implica la protonación del par de electrones de la amina para formar un grupo amonio con carga positiva (RNH+
3) se puede expresar como:
Las especies disociadas e ionizadas resultantes, al ser más solubles en solución, quedan atrapadas o depuradas por la solución de amina y, por lo tanto, se eliminan fácilmente de la fase gaseosa. A la salida del depurador de amina, el gas endulzado se ve así empobrecido en H 2 S y CO 2 .
Un proceso típico de tratamiento de gas de amina (el proceso Girbotol, como se muestra en el diagrama de flujo a continuación) incluye una unidad de absorción y una unidad de regeneración, así como equipo auxiliar. En el absorbedor, la solución de amina que fluye hacia abajo absorbe H2S y CO2 del gas agrio que fluye hacia arriba para producir una corriente de gas endulzada (es decir, un gas libre de sulfuro de hidrógeno y dióxido de carbono) como producto y una solución de amina rica en los gases ácidos absorbidos. La amina "rica" resultante se envía luego al regenerador (un separador con un recalentador ) para producir amina regenerada o "pobre" que se recicla para su reutilización en el absorbedor. El gas de cabeza separado del regenerador es H2S y CO2 concentrados .
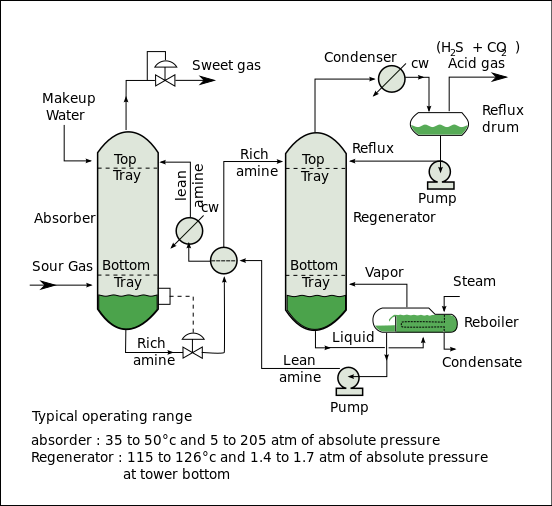
Las configuraciones alternativas del separador incluyen matriz, intercambio interno, alimentación de evaporación instantánea y presión múltiple con alimentación dividida. Muchas de estas configuraciones ofrecen una mayor eficiencia energética para solventes específicos o condiciones de operación. La operación al vacío favorece a los solventes con calores de absorción bajos, mientras que la operación a presión normal favorece a los solventes con calores de absorción altos. Los solventes con calores de absorción altos requieren menos energía para la extracción debido a la oscilación de temperatura a una capacidad fija. El separador de matriz recupera el 40 % del CO2 a una presión más alta y no tiene ineficiencias asociadas con el separador de presión múltiple. La energía y los costos se reducen ya que el ciclo de trabajo del rehervidor es ligeramente menor que el separador de presión normal. Un separador de intercambio interno tiene una proporción menor de vapor de agua a CO2 en la corriente superior y, por lo tanto, se requiere menos vapor. La configuración de presión múltiple con alimentación dividida reduce el flujo hacia la sección inferior, lo que también reduce el trabajo equivalente. La alimentación de evaporación instantánea requiere menos entrada de calor porque utiliza el calor latente del vapor de agua para ayudar a eliminar parte del CO2 en la corriente rica que ingresa al separador en la parte inferior de la columna. La configuración de múltiples presiones es más atractiva para solventes con mayores calores de absorción. [5]
La concentración de amina en la solución acuosa absorbente es un parámetro importante en el diseño y funcionamiento de un proceso de tratamiento de gases de amina. Según cuál de las cuatro aminas siguientes se diseñó para utilizar la unidad y qué gases se diseñó para eliminar, estas son algunas concentraciones de amina típicas, expresadas como porcentaje en peso de amina pura en la solución acuosa: [1]
La elección de la concentración de amina en la solución acuosa circulante depende de varios factores y puede ser bastante arbitraria. Por lo general, se realiza simplemente en función de la experiencia. Los factores que intervienen incluyen si la unidad de amina está tratando gas natural crudo o gases derivados de refinerías de petróleo que contienen concentraciones relativamente bajas tanto de H2S como de CO2 o si la unidad está tratando gases con un alto porcentaje de CO2, como los gases de escape del proceso de reformado con vapor utilizado en la producción de amoníaco o los gases de combustión de las centrales eléctricas . [1]
Tanto el H 2 S como el CO 2 son gases ácidos y, por lo tanto, corrosivos para el acero al carbono . Sin embargo, en una unidad de tratamiento con amina, el CO 2 es el ácido más fuerte de los dos. El H 2 S forma una película de sulfuro de hierro en la superficie del acero que actúa para protegerlo. Cuando se tratan gases con un alto porcentaje de CO 2 , a menudo se utilizan inhibidores de corrosión, lo que permite el uso de concentraciones más altas de amina en la solución circulante.
Otro factor que interviene en la elección de una concentración de amina es la solubilidad relativa del H2S y el CO2 en la amina seleccionada. [1] La elección del tipo de amina afectará la velocidad de circulación requerida de la solución de amina, el consumo de energía para la regeneración y la capacidad de eliminar selectivamente solo el H2S o solo el CO2 si se desea. Para obtener más información sobre la selección de la concentración de amina, se remite al lector al libro de Kohl y Nielsen.
La MEA y la DEA son aminas primarias y secundarias. Son muy reactivas y pueden eliminar eficazmente un gran volumen de gas debido a una alta velocidad de reacción. Sin embargo, debido a la estequiometría , la capacidad de carga está limitada a 0,5 moles de CO2 por mol de amina. [6] La MEA y la DEA también requieren una gran cantidad de energía para eliminar el CO2 durante la regeneración, lo que puede representar hasta el 70 % de los costos operativos totales. También son más corrosivas y químicamente inestables en comparación con otras aminas. [6]
En las refinerías de petróleo, ese gas despojado es principalmente H2S , gran parte del cual a menudo proviene de un proceso de eliminación de azufre llamado hidrodesulfuración . Esta corriente de gas despojado rica en H2S generalmente se envía a un proceso Claus para convertirla en azufre elemental . De hecho, la gran mayoría de las 64.000.000 de toneladas métricas de azufre producidas en todo el mundo en 2005 fue azufre subproducto de refinerías y otras plantas de procesamiento de hidrocarburos. [7] [8] Otro proceso de eliminación de azufre es el Proceso WSA que recupera azufre en cualquier forma como ácido sulfúrico concentrado . En algunas plantas, más de una unidad de absorción de aminas puede compartir una unidad regeneradora común. El énfasis actual en la eliminación de CO2 de los gases de combustión emitidos por las plantas de energía de combustibles fósiles ha generado mucho interés en el uso de aminas para eliminar CO2 ( ver también: captura y almacenamiento de carbono y planta de energía convencional a carbón ).
En el caso específico de la síntesis industrial de amoniaco , para el proceso de reformado con vapor de hidrocarburos para producir hidrógeno gaseoso , el tratamiento con aminas es uno de los procesos comúnmente utilizados para eliminar el exceso de dióxido de carbono en la purificación final del hidrógeno gaseoso.
En la producción de biogás , a veces es necesario eliminar el dióxido de carbono del biogás para que sea comparable con el gas natural. La eliminación del contenido, a veces elevado, de sulfuro de hidrógeno es necesaria para evitar la corrosión de las piezas metálicas después de quemar el biogás. [9]
Las aminas se utilizan para eliminar CO 2 en diversas áreas, desde la producción de gas natural hasta la industria de alimentos y bebidas, y se han utilizado desde 1930. [10]
Existen múltiples clasificaciones de aminas, cada una de las cuales tiene diferentes características relevantes para la captura de CO 2 . Por ejemplo, la monoetanolamina (MEA) reacciona fuertemente con gases ácidos como el CO 2 y tiene un tiempo de reacción rápido y una capacidad para eliminar altos porcentajes de CO 2 , incluso en las bajas concentraciones de CO 2 . Por lo general, la monoetanolamina (MEA) puede capturar entre el 85% y el 90% del CO 2 de los gases de combustión de una planta de carbón, que es uno de los disolventes más eficaces para capturar CO 2 . [11]
Los desafíos de la captura de carbono mediante aminas incluyen:
La presión parcial es la fuerza impulsora para transferir el CO2 a la fase líquida. A baja presión, esta transferencia es difícil de lograr sin aumentar la carga térmica de los rehervidores, lo que se traducirá en mayores costos. [12]
Las aminas primarias y secundarias, por ejemplo, MEA y DEA, reaccionarán con CO2 y formarán productos de degradación. El O2 del gas de entrada también provocará degradación. La amina degradada ya no puede capturar CO2 , lo que disminuye la eficiencia general de captura de carbono. [12]
En la actualidad, se están sintetizando y probando diversas mezclas de aminas para lograr un conjunto más deseable de propiedades generales para su uso en sistemas de captura de CO2 . Uno de los principales objetivos es reducir la energía necesaria para la regeneración del disolvente, lo que tiene un gran impacto en los costes del proceso. Sin embargo, hay que tener en cuenta algunas desventajas. Por ejemplo, la energía necesaria para la regeneración suele estar relacionada con las fuerzas impulsoras para lograr altas capacidades de captura. Por tanto, reducir la energía de regeneración puede reducir la fuerza impulsora y, por tanto, aumentar la cantidad de disolvente y el tamaño del absorbedor necesarios para capturar una cantidad determinada de CO2 , aumentando así el coste de capital. [11]