
El replisoma es una máquina molecular compleja que lleva a cabo la replicación del ADN . El replisoma primero desenrolla el ADN bicatenario en dos hebras simples. Para cada una de las hebras simples resultantes, se sintetiza una nueva secuencia complementaria de ADN. El resultado total es la formación de dos nuevas secuencias de ADN bicatenario que son copias exactas de la secuencia de ADN bicatenario original. [1]
En términos de estructura, el replisoma se compone de dos complejos de polimerasa replicativa, uno de los cuales sintetiza la cadena líder , mientras que el otro sintetiza la cadena rezagada . El replisoma se compone de varias proteínas, entre ellas helicasa , RFC , PCNA , girasa / topoisomerasa , SSB / RPA , primasa , ADN polimerasa III , ARNasa H y ADN ligasa .
En los procariotas , cada nucleoide en división (región que contiene material genético que no es un núcleo) requiere dos replisomas para la replicación bidireccional . Los dos replisomas continúan la replicación en ambas horquillas en el medio de la célula. Finalmente, a medida que se replica el sitio de terminación, los dos replisomas se separan del ADN. El replisoma permanece en una ubicación fija en la mitad de la célula, unido a la membrana , y el ADN molde pasa a través de él. El ADN se alimenta a través del par estacionario de replisomas ubicados en la membrana celular.
En los eucariotas , se forman numerosas burbujas de replicación en los orígenes de replicación a lo largo del cromosoma . Al igual que en los procariotas, se requieren dos replisomas, uno en cada horquilla de replicación ubicada en el extremo de la burbuja de replicación. Debido a las diferencias significativas en el tamaño de los cromosomas y las complejidades asociadas de los cromosomas altamente condensados, varios aspectos del proceso de replicación del ADN en eucariotas, incluidas las fases terminales, están menos bien caracterizados que en los procariotas.
El replisoma es un sistema en el que varios factores trabajan juntos para resolver los desafíos estructurales y químicos de la replicación del ADN. El tamaño y la estructura de los cromosomas varían entre organismos, pero como las moléculas de ADN son el reservorio de información genética para todas las formas de vida, muchos desafíos y soluciones de replicación son los mismos para diferentes organismos. Como resultado, los factores de replicación que resuelven estos problemas están altamente conservados en términos de estructura, química, funcionalidad o secuencia. Los desafíos estructurales y químicos generales incluyen los siguientes:
En general, los desafíos de la replicación del ADN involucran la estructura de las moléculas, la química de las moléculas y, desde una perspectiva de sistemas, las relaciones subyacentes entre la estructura y la química.
Muchos de los problemas estructurales y químicos asociados con la replicación del ADN son gestionados por una maquinaria molecular que está muy conservada en todos los organismos. En esta sección se analiza cómo los factores replisómicos resuelven los desafíos estructurales y químicos de la replicación del ADN.
La replicación del ADN comienza en lugares denominados orígenes de replicación. En organismos con genomas pequeños y una estructura cromosómica simple, como las bacterias, puede haber solo unos pocos orígenes de replicación en cada cromosoma. Los organismos con genomas grandes y una estructura cromosómica compleja, como los humanos, pueden tener cientos o incluso miles de orígenes de replicación repartidos en múltiples cromosomas.
La estructura del ADN varía con el tiempo, el espacio y la secuencia, y se cree que estas variaciones, además de su papel en la expresión génica, también desempeñan un papel activo en el ensamblaje del replisoma durante la síntesis del ADN. El ensamblaje del replisoma en un origen de replicación se divide aproximadamente en tres fases.
Para las bacterias:
Para eucariotas:
Tanto para las bacterias como para los eucariotas, la siguiente etapa generalmente se denomina "elongación", y es durante esta fase que ocurre la mayor parte de la síntesis de ADN.
El ADN es un dúplex formado por dos cadenas antiparalelas. Según Meselson-Stahl , el proceso de replicación del ADN es semiconservativo, por lo que durante la replicación el dúplex de ADN original se separa en dos cadenas hijas (denominadas cadenas principales y cadenas rezagadas). Cada cadena hija pasa a formar parte de un nuevo dúplex de ADN. Los factores denominados genéricamente helicasas desenrollan el dúplex.
La helicasa es una enzima que rompe los enlaces de hidrógeno entre los pares de bases en el medio del dúplex de ADN. Su estructura en forma de rosquilla envuelve el ADN y separa las hebras antes de la síntesis de ADN. En los eucariotas, el complejo Mcm2-7 actúa como una helicasa, aunque no está del todo claro qué subunidades son necesarias para la actividad de la helicasa. [2] Esta helicasa se transloca en la misma dirección que la ADN polimerasa (3' a 5' con respecto a la hebra molde). En los organismos procariotas, las helicasas se identifican mejor e incluyen dnaB , que se mueve 5' a 3' en la hebra opuesta a la ADN polimerasa.
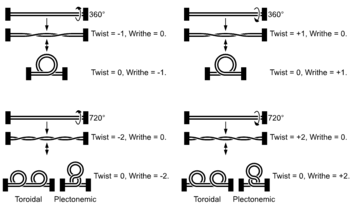
A medida que la helicasa desenrolla la doble hélice, los cambios topológicos inducidos por el movimiento de rotación de la helicasa conducen a la formación de una superenrollación delante de la helicasa (similar a lo que sucede cuando se tuerce un trozo de hilo).
La girasa (una forma de topoisomerasa ) relaja y deshace el superenrollamiento causado por la helicasa. Lo hace cortando las cadenas de ADN, lo que le permite rotar y liberar el superenrollamiento, y luego vuelve a unir las cadenas. La girasa se encuentra más comúnmente aguas arriba de la horquilla de replicación, donde se forman los superenrollamientos.

El ADN monocatenario es muy inestable y puede formar enlaces de hidrógeno consigo mismo, conocidos como "horquillas" (o la cadena simple puede unirse incorrectamente a la otra cadena simple). Para contrarrestar esta inestabilidad, las proteínas de unión de cadena simple (SSB en procariotas y proteína de replicación A en eucariotas) se unen a las bases expuestas para evitar una ligadura incorrecta.
Si consideramos cada hebra como una "cuerda elástica y dinámica", el potencial estructural para una ligadura inadecuada debería ser obvio.
Un esquema ampliado revela la química subyacente del problema: el potencial de formación de enlaces de hidrógeno entre pares de bases no relacionados.
Las proteínas de unión estabilizan la cadena única y la protegen de daños causados por reacciones químicas no autorizadas.
La combinación de una sola hebra y sus proteínas de unión sirve como un mejor sustrato para las polimerasas replicativas que una sola hebra desnuda (las proteínas de unión proporcionan una fuerza impulsora termodinámica adicional para la reacción de polimerización). Las proteínas de unión de la hebra son eliminadas por las polimerasas replicativas.
Desde una perspectiva estructural y química, una sola hebra de ADN por sí sola (y las proteínas de unión a la hebra simple asociadas) no es adecuada para la polimerización. Esto se debe a que las reacciones químicas catalizadas por las polimerasas replicativas requieren un 3' OH libre para iniciar la elongación de la cadena de nucleótidos. En términos de estructura, la conformación de los sitios activos de la polimerasa replicativa (que está altamente relacionada con la precisión inherente de las polimerasas replicativas) significa que estos factores no pueden iniciar la elongación de la cadena sin una cadena de nucleótidos preexistente, porque ninguna polimerasa replicativa conocida puede iniciar la elongación de la cadena de novo.
Las enzimas de cebado (que son ARN polimerasas dependientes del ADN ) resuelven este problema creando un cebador de ARN en las cadenas líder y rezagada. La cadena líder se ceba una vez y la cadena rezagada se ceba aproximadamente cada 1000 (+/- 200) pares de bases (un cebador por cada fragmento de Okazaki en la cadena rezagada). Cada cebador de ARN tiene aproximadamente 10 bases de longitud.
La interfaz en (A*) contiene un 3' OH libre que es químicamente adecuado para la reacción catalizada por polimerasas replicativas, y la configuración de "saliente" es estructuralmente adecuada para la elongación de la cadena por una polimerasa replicativa. Por lo tanto, las polimerasas replicativas pueden comenzar la elongación de la cadena en (A*).
En los procariotas, la primasa crea un cebador de ARN al comienzo de las cadenas líder y rezagada recién separadas.
En los eucariotas, la ADN polimerasa alfa crea un cebador de ARN al comienzo de las cadenas líder y rezagada recién separadas y, a diferencia de la primasa, la ADN polimerasa alfa también sintetiza una cadena corta de desoxirribonucleótidos después de crear el cebador.
La procesividad se refiere tanto a la velocidad como a la continuidad de la replicación del ADN, y una alta procesividad es un requisito para una replicación oportuna. La alta procesividad está garantizada en parte por proteínas en forma de anillo denominadas "abrazaderas" que ayudan a las polimerasas replicativas a permanecer asociadas con las cadenas líder y rezagada. También hay otras variables: desde una perspectiva química, las proteínas de unión a la cadena estimulan la polimerización y proporcionan energía termodinámica adicional para la reacción. Desde una perspectiva de sistemas, la estructura y la química de muchos factores del replisoma (como las características de ATPasa AAA+ de las subunidades de carga de las abrazaderas individuales, junto con la conformación helicoidal que adoptan) y las asociaciones entre los factores de carga de las abrazaderas y otros factores accesorios, también aumentan la procesividad.
Hasta este punto, según la investigación de Kuriyan et al., [3] debido a su papel en el reclutamiento y la unión de otros factores como las enzimas de cebado y las polimerasas replicativas, los cargadores de pinzas y las pinzas deslizantes son el corazón de la maquinaria del replisoma. La investigación ha descubierto que los factores de carga de pinzas y de pinzas deslizantes son absolutamente esenciales para la replicación, lo que explica el alto grado de conservación estructural observado para los factores de carga de pinzas y de pinzas deslizantes. Esta conservación arquitectónica y estructural se observa en organismos tan diversos como bacterias, fagos, levaduras y humanos. El hecho de que se observe un grado tan significativo de conservación estructural sin homología de secuencias refuerza aún más la importancia de estas soluciones estructurales para los desafíos de la replicación.
El término "cargador de pinza" hace referencia a los factores de replicación denominados gamma (bacterias) o RFC (eucariotas). La combinación de ADN molde y ARN cebador se denomina " ADN en forma A " y se cree que las proteínas de replicación de carga de pinza (heteropentámeros helicoidales) quieren asociarse con el ADN en forma A debido a su forma (la estructura del surco mayor/menor) y su química (patrones de donantes y aceptores de enlaces de hidrógeno ). [3] [4] Por lo tanto, las proteínas de carga de pinza se asocian con la región cebada de la hebra, lo que provoca la hidrólisis del ATP y proporciona energía para abrir la pinza y unirla a la hebra. [3] [4]

La pinza deslizante es un término genérico que se refiere a factores de replicación en forma de anillo llamados beta (bacterias) o PCNA (eucariotas y arqueas). Las proteínas de la pinza atraen y unen polimerasas replicativas, como la ADN polimerasa III, para extender la cantidad de tiempo que una polimerasa replicativa permanece asociada con la cadena. Desde una perspectiva química, la pinza tiene una carga ligeramente positiva en su centro que coincide casi a la perfección con la carga ligeramente negativa de la cadena de ADN.
En algunos organismos, la abrazadera es un dímero y en otros, un trímero. En cualquier caso, la arquitectura del anillo conservada permite que la abrazadera encierre la hebra.
Las polimerasas replicativas forman un dímero asimétrico en la horquilla de replicación al unirse a subunidades del factor de carga de la pinza. Esta conformación asimétrica es capaz de replicar simultáneamente las cadenas líder y rezagada, y el conjunto de factores que incluye las polimerasas replicativas generalmente se conoce como holoenzima . Sin embargo, siguen existiendo desafíos importantes: las cadenas líder y rezagada son antiparalelas. Esto significa que la síntesis de nucleótidos en la cadena líder ocurre naturalmente en la dirección 5' a 3'. Sin embargo, la cadena rezagada va en la dirección opuesta y esto presenta un gran desafío ya que ninguna polimerasa replicativa conocida puede sintetizar ADN en la dirección 3' a 5'.
La dimerización de las polimerasas replicativas resuelve los problemas relacionados con la sincronización eficiente de la síntesis de las cadenas líder y rezagada en la horquilla de replicación, pero el estrecho acoplamiento espacial-estructural de las polimerasas replicativas, si bien resuelve el difícil problema de la sincronización, crea otro desafío: la dimerización de las polimerasas replicativas en la horquilla de replicación significa que la síntesis de nucleótidos para ambas cadenas debe tener lugar en la misma ubicación espacial, a pesar del hecho de que la cadena rezagada debe sintetizarse al revés en relación con la cadena líder. La síntesis de la cadena rezagada tiene lugar después de que la helicasa haya desenrollado una cantidad suficiente de la cadena rezagada, y esta "cantidad suficiente de la cadena rezagada" se polimeriza en cadenas de nucleótidos discretas llamadas fragmentos de Okazaki.
Considere lo siguiente: la helicasa desenrolla continuamente el dúplex parental, pero la hebra rezagada debe polimerizarse en la dirección opuesta. Esto significa que, mientras que la polimerización de la hebra líder continúa, la polimerización de la hebra rezagada solo ocurre después de que la helicasa haya desenrollado una cantidad suficiente de la hebra rezagada. En este punto, la polimerasa replicativa de la hebra rezagada se asocia con la abrazadera y el cebador para iniciar la polimerización. Durante la síntesis de la hebra rezagada, la polimerasa replicativa envía la hebra rezagada de regreso hacia la horquilla de replicación. La polimerasa replicativa se disocia cuando alcanza un cebador de ARN. La helicasa continúa desenrollando el dúplex parental, la enzima de cebado fija otro cebador y la polimerasa replicativa se reasocia con la abrazadera y el cebador cuando se ha desenrollado una cantidad suficiente de la hebra rezagada.
En conjunto, la síntesis de la cadena líder y la rezagada se denomina "semidiscontinua".
Los organismos procariotas y eucariotas utilizan una variedad de polimerasas replicativas, algunas de las cuales están bien caracterizadas:
Esta polimerasa sintetiza ADN de cadena líder y rezagada en bacterias.
Esta polimerasa sintetiza ADN de cadena retrasada en eucariotas. [5] (Se cree que forma un dímero asimétrico con la ADN polimerasa épsilon). [6]
Esta polimerasa sintetiza la cadena principal de ADN en eucariotas. [7] (Se cree que forma un dímero asimétrico con la ADN polimerasa delta). [5]
Aunque es poco frecuente, durante la elongación de la cadena se produce una polimerización por apareamiento incorrecto de bases (la estructura y la química de las polimerasas replicativas hacen que los errores sean poco probables, pero ocurren). Muchas polimerasas replicativas contienen un mecanismo de "corrección de errores" en forma de un dominio de exonucleasa 3' a 5' que es capaz de eliminar pares de bases del extremo 3' expuesto de la cadena en crecimiento. La corrección de errores es posible porque los errores de pares de bases distorsionan la posición de los iones de magnesio en la subunidad de polimerización, y la distorsión estructural-química de la unidad de polimerización detiene efectivamente el proceso de polimerización al ralentizar la reacción. [8] Posteriormente, la reacción química en la unidad de exonucleasa toma el control y elimina nucleótidos del extremo 3' expuesto de la cadena en crecimiento. [9] Una vez que se elimina un error, la estructura y la química de la unidad de polimerización vuelven a la normalidad y la replicación del ADN continúa. Al trabajar colectivamente de esta manera, el sitio activo de polimerización puede considerarse como el "corrector", ya que detecta los desajustes, y la exonucleasa es el "editor", ya que corrige los errores.
Los errores de pares de bases distorsionan el sitio activo de la polimerasa entre 4 y 6 nucleótidos, lo que significa que, dependiendo del tipo de desajuste, hay hasta seis posibilidades de corrección de errores. [8] Las características de detección y corrección de errores, combinadas con la precisión inherente que surge de la estructura y la química de las polimerasas replicativas, contribuyen a una tasa de error de aproximadamente 1 desajuste de par de bases en 10 8 a 10 10 pares de bases.
Los errores se pueden clasificar en tres categorías: desajustes purina-purina, desajustes pirimidina-pirimidina y desajustes pirimidina-purina. La química de cada desajuste varía, al igual que el comportamiento de la polimerasa replicativa con respecto a su actividad de detección de desajustes.
La replicación del ADN del bacteriófago T4 tras la infección de E. coli es un sistema de replicación de ADN bien estudiado. Durante el período de aumento exponencial del ADN a 37 °C, la tasa de elongación es de 749 nucleótidos por segundo. [11] La tasa de mutación durante la replicación es de 1,7 mutaciones por 10 8 pares de bases. [12] Por lo tanto, la replicación del ADN en este sistema es muy rápida y muy precisa.
Existen dos problemas después de la síntesis de la cadena líder y la cadena rezagada: el ARN permanece en el dúplex y hay muescas entre cada fragmento de Okazaki en el dúplex rezagado. Estos problemas se resuelven mediante una variedad de enzimas de reparación del ADN que varían según el organismo, entre ellas: ADN polimerasa I, ADN polimerasa beta, ARNasa H, ligasa y ADN2. Este proceso está bien caracterizado en bacterias y mucho menos bien caracterizado en muchos eucariotas.
En general, las enzimas reparadoras del ADN completan los fragmentos de Okazaki a través de diversos medios, entre ellos: la escisión de pares de bases y la actividad de la exonucleasa 5' a 3' que elimina los ribonucleótidos químicamente inestables del dúplex rezagado y los reemplaza con desoxinucleótidos estables. Este proceso se conoce como "maduración de los fragmentos de Okazaki" y la ligasa (ver a continuación) completa el paso final del proceso de maduración.
La eliminación de cebadores y la ligadura de muescas pueden considerarse procesos de reparación del ADN que producen un dúplex libre de errores y químicamente estable. Hasta este punto, con respecto a la química de un dúplex ARN-ADN, además de la presencia de uracilo en el dúplex, la presencia de ribosa (que tiene un 2' OH reactivo) tiende a hacer que el dúplex sea mucho menos estable químicamente que un dúplex que contiene solo desoxirribosa (que tiene un 2' H no reactivo).
La ADN polimerasa I es una enzima que repara el ADN.
La ARNasa H es una enzima que elimina el ARN de un dúplex ARN-ADN.
Después de que los factores de reparación del ADN sustituyen los ribonucleótidos del cebador por desoxinucleótidos, queda un único espacio en la cadena principal de azúcar y fosfato entre cada fragmento de Okazaki en el dúplex rezagado. Una enzima llamada ADN ligasa conecta el espacio en la cadena principal formando un enlace fosfodiéster entre cada espacio que separa los fragmentos de Okazaki. Los aspectos estructurales y químicos de este proceso, generalmente denominado "traslación de mellas", exceden el alcance de este artículo.
El estrés de replicación puede provocar el bloqueo de la horquilla de replicación. Un tipo de estrés replicativo es el resultado de daños en el ADN, como los enlaces cruzados entre cadenas (ICL). Un ICL puede bloquear la progresión de la horquilla replicativa debido a la falla en la separación de las cadenas de ADN. En las células de vertebrados, la replicación de una plantilla de cromatina que contiene ICL desencadena el reclutamiento de más de 90 factores de reparación del ADN y mantenimiento del genoma . [13] Estos factores incluyen proteínas que realizan incisiones secuenciales y recombinación homóloga .
Katherine Lemon y Alan Grossman demostraron, utilizando Bacillus subtilis , que los replisomas no se mueven como trenes a lo largo de una vía, sino que el ADN en realidad se alimenta a través de un par estacionario de replisomas ubicados en la membrana celular. En su experimento, los replisomas en B. subtilis fueron marcados con proteína fluorescente verde, y la ubicación del complejo fue monitoreada en células replicantes utilizando microscopía de fluorescencia . Si los replisomas se movieran como un tren en una vía, la proteína polimerasa-GFP se encontraría en diferentes posiciones en cada célula. Sin embargo, en cada célula replicante, los replisomas se observaron como focos fluorescentes distintos ubicados en o cerca de la mitad de la célula. El ADN celular teñido con un tinte fluorescente azul (DAPI) claramente ocupó la mayor parte del espacio citoplasmático. [14]