El dicianoaurato de potasio (o cianuro de oro y potasio ) es un compuesto inorgánico de fórmula K[Au(CN) 2 ]. Es un sólido de incoloro a blanco que es soluble en agua y ligeramente soluble en alcohol. La sal en sí a menudo no está aislada, sino que se generan soluciones del ion dicianoaurato ([Au(CN) 2 ] − ) a gran escala en la extracción de oro de sus minerales. [3]
En la extracción de oro de fuentes diluidas, el oro se extrae selectivamente mediante disolución en soluciones acuosas de cianuro, obtenidas mediante la disolución de cianuro de sodio, cianuro de potasio y/o cianuro de calcio . La reacción para la disolución del oro, la "Ecuación de Elsner", es:
En este proceso, el oxígeno es el oxidante. [4]
También se puede producir mediante la reacción de sales de oro (I) con un exceso de cianuro de potasio.
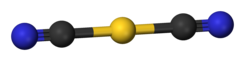
El dicianoaurato de potasio es una sal. El anión dicianoaurato es lineal según cristalografía de rayos X. [3] Según la espectroscopia infrarroja , el anión dicianoaurato adopta una estructura muy similar al dicianoaurato de sodio (NaAu(CN) 2 ). [5]
El dicianoaurato es la especie soluble en la que se centra la cianuración del oro , el proceso hidrometalúrgico para obtener oro a partir de minerales diluidos. De hecho, el cianuro de sodio, no la sal de potasio, se utiliza más ampliamente en los procesos comerciales. [6]
Aparte de su uso principal como intermediario en la extracción de oro, el dicianoaurato de potasio se utiliza a menudo en aplicaciones de enchapado en oro .
El compuesto que contiene cianuro de oro(III) también se conoce: tetracianoaurato(III) de potasio, K[Au(CN) 4 ]. Su uso es menos común.
El ion potasio se puede reemplazar con cationes de amonio cuaternario como en el dicianoaurato de tetrabutilamonio . [7]
La ingestión de gramos de dicianoaurato de potasio ha provocado la muerte. [8]