
Los digerminos son una clase de compuestos que se consideran los análogos de digermanio más pesados de los alquinos . El miembro padre de toda esta clase es HGeGeH, que sólo se ha caracterizado computacionalmente, pero ha revelado características clave de toda la clase. Debido a la gran repulsión interatómica entre dos átomos de Ge, sólo se pueden sintetizar y caracterizar moléculas de digermina cinéticamente estabilizadas utilizando grupos protectores voluminosos y métodos sintéticos apropiados, por ejemplo, acoplamiento reductor de haluros de germanio (II).
El enlace entre dos átomos de Ge en el digermino es diferente del enlace C≡C en los alquinos, lo que da como resultado la estructura trans -doblada del digermino. La estructura trans -doblada es bastante común en los análogos de alquinos de elementos más pesados del Grupo 14. [1] El efecto Jahn-Teller (SOJT) de segundo orden de los digerminos da lugar a un enlace π deslizado y a una gran distorsión geométrica molecular.
Debido a la característica de enlaces múltiples de los digerminos y a la gran repulsión interatómica de dos átomos de Ge, que por lo tanto conduce a la larga distancia germanio-germanio, los digerminos son muy reactivos y pueden sufrir diferentes tipos de reacciones, como [2+1] y [2 +2] reacción de cicloadición con diferentes tipos de moléculas insaturadas, [4+1] cicloadición con 1,3-dimetil-1,3-butadieno, reacción de adición de alcoholes y agua, y actúa como donante de electrones π para sufrir una reacción de coordinación con ion plata.
Aunque muchos estudios computacionales han calculado las estructuras y energías de la molécula original HGeGeH [2] [3] y digerminas con sustitutos orgánicos, [4] solo pueden sintetizarse y aislarse mediante la protección de grupos R voluminosos. Se ha demostrado que la estrategia sintética que reduce el precursor adecuado, generalmente haluros de germanio (II) con grupos protectores voluminosos, mediante reductores fuertes es poderosa para sintetizar digerminos.

La primera digermina estable 2,6-Dipp 2 H 3 C 6 GeGeC 6 H 3 -2,6-Dipp 2 (Ar 1 GeGeAr 1 , Dipp = 2,6-diisopropilfenilo) fue sintetizada y caracterizada por Philip P. Power y co. -Trabajadores en 2002. [5] El acoplamiento reductor del voluminoso grupo 2,6-Dipp 2 -C 6 H 3 (Ar 1 ) protegió el monocloruro de Ge (II) (Ge (Cl) Ar 1 ) bajo el tratamiento de potasio en tetrahidrofurano ( THF) o benceno dieron la formación de Ar 1 GeGeAr 1 . La estructura central C1-Ge1-Ge2-C2 tiene una característica de transflexión centrosimétrica , con el ángulo C1-Ge1-Ge2 de 128,67 (8) ° y una distancia considerablemente corta de 2,2850 (6) Å entre dos átomos de Ge. Tiene una buena conjugación entre dos anillos de terfenilo y el plano C1-Ge1-Ge2-C2 debido al ángulo de torsión casi nulo (0,4°) que presenta. Una molécula similar, denominada Ar 2 GeGeAr 2, se calculó antes de la caracterización de Ar 1 GeGeAr 1 , con la estructura central trans -doblada optimizada protegida por 2,6-Trip 2 C 6 H 2 aún más poblado (Ar 2 , Trip = 2 (4,6-triisopropilfenilo). [4] La flexión trans en Ar 2 GeGeAr 2 (123,2°) es comparable con Ar 1 GeGeAr 1 , y la distancia Ge-Ge de 2,277 Å también difiere poco de la de Ar 1 GeGeAr 1 . Ar 2 GeGeAr 2 se obtuvo utilizando el mismo método de reducción [6] y proporcionó una estructura similar a la calculada y Ar 1 GeGeAr 1 .
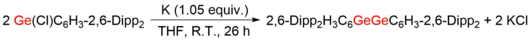
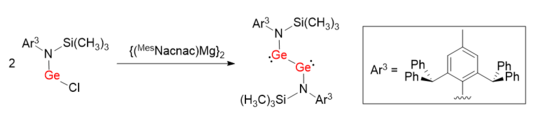
Se utilizó un método sintético similar para facilitar la síntesis de un digermino LGeGeL con un enlace simple Ge-Ge. [7] En lugar de aprovechar ligandos voluminosos con carbono como átomo coordinador, se utilizó el grupo protector L basado en nitrógeno (L = N(Si(CH 3 ) 3 )(Ar 3 )). Los ángulos de enlace de N-Ge-Ge son 100,09(6)°, que están mucho más distorsionados que Ar 1 GeGeAr 1 y Ar 2 GeGeAr 2 .
El trans -dibromodigermileno estéricamente poblado , que está protegido por grupos 2,6-bis[bis(trimetilsilil)metil]-4-[tris(trimetilsilil)metil]fenilo (Bbt), se puede reducir con dos equivalentes de grafito potásico (KC 8 ) en benceno a temperatura ambiente para dar origen al digermino correspondiente BbtGe≡GeBbt. [8]

La diferencia más obvia entre alquinos y digerminos, y también entre otros análogos de alquinos más pesados, es la geometría molecular, que es lineal en los alquinos, pero transcurvada en todos los análogos de alquinos más pesados. Esta enorme diferencia en la geometría molecular es el resultado de la diferencia entre el triple enlace carbono-carbono y el enlace de dos átomos más pesados del grupo 14, por ejemplo, los átomos de germanio. Los elementos más pesados del grupo 14 tienen radios covalentes mucho mayores que el carbono. Por ejemplo, los radios de los enlaces simples y triples del carbono son 75 Å y 60 Å respectivamente, mientras que los radios de los enlaces simples y triples del germanio son 121 Å y 114 Å respectivamente, que son aproximadamente un 50% más largos. [9] El sistema de triple enlace REER de los elementos del grupo 14 puede verse como la interacción entre dos fragmentos de ER cuarteto o dos fragmentos de ER doblete. El primer caso corresponde a la estructura plana, mientras que el segundo representa la estructura trans -doblada. Los fragmentos del cuarteto ER tienen menor energía que el doblete solo cuando E es carbono, es decir, para elementos más pesados del grupo 14, la estructura trans -doblada se ve más favorecida energéticamente que la estructura plana. Por ejemplo, los fragmentos HGe y PhGe de HGeGeH y PhGeGePh son 44,2 y 44,1 kcal/mol más estables en energía que los estados del cuarteto respectivamente, bajo el nivel de cálculo de B3PW91/6-311+G(2df) (para Ge), 6- 31G(d) (para C, H). [10] El criterio de una estructura trans -doblada puede ser dado por el modelo CGMT. [11] Por lo tanto, el enlace entre dos átomos de Ge en digerminos puede describirse como interacciones donante-aceptor utilizando modelos de enlace de valencia.
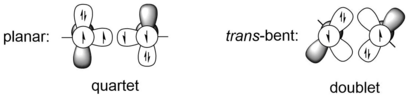
Se puede ver en las representaciones de enlace que los átomos de Ge están unidos por un enlace σ y dos enlaces donante-aceptor (desde un orbital híbrido sp lleno hasta un orbital p vacío) o un enlace σ y un enlace π con un par solitario resonante o dos radicales en cada átomo de Ge. Según las estructuras de resonancia, uno de los dos átomos de Ge tiene una carga positiva parcial y tiene deficiencia de electrones, el otro átomo de Ge tiene un par de electrones libres y es capaz de donar algo de densidad electrónica.

Los ángulos de enlace anormales y la característica de enlace simple de LGeGeL pueden racionalizarse mediante el carácter donador de electrones del átomo de N, lo que conduce a la formación de la interacción N p (π) → Ge (orbital p vacío). Por lo tanto, los enlaces donante-aceptor entre dos átomos de Ge se debilitan y se parecen más a pares de electrones solitarios no enlazantes. Se ha sugerido que el orden de enlace del enlace Ge-Ge se ve afectado hasta cierto punto por las propiedades electrónicas de los grupos protectores voluminosos. [8]

En una descripción de orbitales moleculares (MO), la distorsión geométrica (estructura trans-doblada) de los digerminos es la consecuencia del efecto Jahn-Teller (SOJT) de segundo orden, que es la simetría que permite la interacción entre los MO de enlace lleno (generalmente el HOMO en digermynes) y MO vacíos no enlazantes o antienlazantes (generalmente el último) que tienen energías cercanas y pueden conducir a una gran distorsión molecular. Si se restringe la molécula de digermino en el grupo de puntos D ∞h , dos átomos de Ge formarán un orbital de enlace σ bajo, dos orbitales de enlace π degenerados y orbitales antienlazante π, y un orbital antienlazante σ alto, que son lo mismo que los alquinos. La mezcla SOJT del orbital de enlace π en plano (π x , HOMO) y el orbital antienlazante σ, que tienen la misma simetría b u en el grupo de puntos C 2h trans -doblados , da lugar a un enlace π deslizado con no significativa -carácter de par solitario de electrones enlazados que tiene menor energía, así como un orbital antienlazante σ con mayor energía. Esta mezcla de segundo orden de MO conduce a la distorsión molecular en la geometría desde lineal D ∞h hasta trans -doblado C 2h . La mezcla de orbital enlazante σ y orbital antienlazante π en plano (π x * , LUMO) también se permite simétricamente (ambos están en simetría b g ) y energéticamente. Al darse cuenta de que se produce un gran efecto SOJT entre dos orbitales con una diferencia de energía de 2 eV o incluso mayor, por ejemplo, 4 eV, el grado de mezcla de orbitales es despreciable en los alquinos, pero se maximiza en elementos más pesados, como los átomos de Ge en los digerminos. [12]
Debido a la característica de enlaces múltiples de los digerminos y la gran repulsión interatómica de dos átomos de Ge, los digerminos pueden sufrir reacciones de cicloadición con alquenos y alquinos, como etileno y acetileno.
Los digerminos son capaces de reaccionar con una variedad de moléculas pequeñas insaturadas, incluidos alquinos, alquenos, PhN = NPh, isocianuros y azidas, debido a sus enlaces Ge-Ge relativamente débiles. Se ha demostrado que existen dos tipos de modos de reacción cuando BbtGeGeBbt se trata con etileno, y ambos se someten a una reacción de cicloadición [1+2] al principio para producir un intermedio de germileno sustituido con germirano. El átomo Ge del sustituyente germirano luego se inserta fácilmente en uno de los enlaces Ge-C del germileno para generar 1,2-digermaciclobuteno, lo que se ha ilustrado tanto experimentalmente [13] como computacionalmente. [13] [14] En el caso de que la presión del etileno sea aproximadamente 1 atm, el 1,2-digermaciclobuteno reacciona además con un equivalente de etileno a través de la misma reacción de cicloadición para producir un digermano con dos Ge 2 C 2 de cuatro miembros. anillos, mientras que el digermano con dos anillos GeC 2 de tres miembros se obtiene con mayor presión de etileno. Se ha sugerido que el primero es un producto termodinámicamente estable, mientras que el segundo sólo es cinéticamente estable.

De manera similar, tienen lugar reacciones de cicloadición [2+2] entre digerminos y alquinos, por ejemplo PhC≡CPh, que conducen a la formación de 1,2-digermaciclobutadieno. [15]

A diferencia de los alquinos que se someten a una reacción de cicloadición [4+2] con 2,3-dimetil-1,3-butadieno para dar derivados de 1,4-ciclohexadieno, los digerminos se someten a una reacción de cicloadición [4+1] debido a la presencia de compuestos extremadamente reactivos. carácter diradical, que se puede observar en los modelos de orbitales de valencia. En el caso de Ar 2 GeGeAr 2 , reacciona con 2,3-dimetil-1,3-butadieno para producir un derivado relacionado inusual. La reacción comienza entre cada uno de los centros radicales y 2,3-dimetil-1,3-butadieno primero, lo que da lugar a la formación de digermano con dos anillos de germaciclopent-3-eno mediante cicloadición [4+1]. El aumento de la repulsión estérica de dos anillos de GeC 4 conduce a la escisión homolítica del enlace simple Ge-Ge que luego produce el parentesco final mediante una reacción de adición 1,4 con un equivalente adicional del 2,3-dimetil-1,3-butadieno. . [6] [15] La ruptura del enlace Ge-Ge no se ve cuando BbtGeGeBbt reacciona con 2,3-dimetil-1,3-butadieno, que solo da lugar a digermano. [8]
Se ha demostrado que BbtGeGeBbt puede sufrir una reacción de adición con alcoholes como metanol y agua para generar 1,1-dimetoxidigermano y 1,1-dihidroxidigermano, respectivamente, lo que demuestra el carácter de enlaces múltiples de los digerminos. [8]


Al notar que el orbital de enlace a u (π) en digerminos tiene la capacidad de actuar como donante de electrones π, Ar 1 GeGeAr 1 puede reaccionar con AgSbF 6 para formar [AgAr 1 GeGeAr 1 ] + SbF 6 − a -40 °C . [16] [AgAr 1 GeGeAr 1 ] + tiene un eje C 2 a través del átomo de plata que es perpendicular a la llanura CGeGeC y al punto medio del enlace Ge-Ge. El átomo de plata está coordinado por dos átomos de Ge y dos arenos de los grupos Dipp de los grupos protectores voluminosos. El enlace entre la fracción GeGe y Ag + está dominado por la interacción entre el HOMO de Ar 1 GeGeAr 1 y los orbitales 5s y 5p de Ag + , lo que reclama el carácter σ de la interacción, mientras que el carácter π puede explicarse por el interacción relativamente débil del orbital Ag 4d xz con el orbital π* (LUMO+1). Por lo tanto, se ha sugerido que [AgAr 1 GeGeAr 1 ] + es un híbrido de complejo π y un complejo σ similar a metalaciclopropeno.