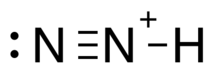
Diazenylium es la sustancia química N 2 H + , un catión inorgánico que fue uno de los primeros iones observados en las nubes interestelares . Desde entonces, se ha observado en varios tipos diferentes de entornos interestelares , observaciones que tienen varios usos científicos diferentes. Proporciona a los astrónomos información sobre la ionización fraccionada de las nubes de gas, la química que ocurre dentro de esas nubes y, a menudo, se utiliza como marcador de moléculas que no se detectan tan fácilmente (como el N 2 ). [1] Su transición rotacional 1-0 ocurre a 93,174 GHz, una región del espectro donde la atmósfera de la Tierra es transparente [2] y tiene una profundidad óptica significativa tanto en nubes frías como cálidas [3] por lo que es relativamente fácil de observar. con observatorios terrestres. Los resultados de las observaciones de N 2 H + se pueden utilizar no sólo para determinar la química de las nubes interestelares, sino también para mapear los perfiles de densidad y velocidad de estas nubes. [4]
N 2 H + fue observado por primera vez en 1974 por BE Turner. Observó un triplete no identificado previamente a 93,174 GHz utilizando el telescopio NRAO de 11 m. [5] Inmediatamente después de esta observación inicial, Green et al. identificó el triplete como la transición rotacional 1-0 de N 2 H + . Esto se hizo usando una combinación de cálculos moleculares ab initio y comparación de moléculas similares, como N 2 , CO , HCN , HNC y HCO + , todas isoelectrónicas con respecto a N 2 H + . Según estos cálculos, se esperaría que la transición rotacional observada tuviera siete componentes hiperfinos, pero sólo se observaron tres de ellos, ya que la resolución del telescopio era insuficiente para distinguir los picos causados por la división hiperfina del átomo de nitrógeno interno. [6] Sólo un año después, Thaddeus y Turner observaron la misma transición en la nube molecular de Orión 2 (OMC-2) usando el mismo telescopio, pero esta vez se integraron durante 26 horas, lo que resultó en una resolución que fue lo suficientemente buena como para distinguir los componentes hiperfinos más pequeños. [7]
Durante las últimas tres décadas, se ha observado N 2 H + con bastante frecuencia, y la banda rotacional 1-0 es casi exclusivamente la que buscan los astrónomos. En 1995, la estructura hiperfina de este septillizo se observó con una precisión absoluta de ~7 kHz, que fue lo suficientemente buena como para determinar sus constantes moleculares con un orden de magnitud mejor que la precisión posible en el laboratorio. [8] Esta observación se realizó hacia L1512 utilizando el telescopio NEROC Haystack de 37 m. Ese mismo año, Sage et al. observaron la transición 1-0 de N 2 H + en siete de las nueve galaxias cercanas que observaron con el telescopio NRAO de 12 m en Kitt Peak. [9] N 2 H + fue uno de los primeros iones moleculares observados en otras galaxias, y su observación ayudó a demostrar que la química en otras galaxias es bastante similar a la que vemos en nuestra propia galaxia.
El N 2 H + se observa con mayor frecuencia en nubes moleculares densas, donde ha demostrado ser útil como una de las últimas moléculas en congelarse en granos de polvo a medida que la densidad de la nube aumenta hacia el centro. En 2002, Bergin et al. Hizo un estudio espacial de núcleos densos para ver a qué distancia hacia el centro se podía observar N 2 H + y descubrió que su abundancia cae al menos dos órdenes de magnitud cuando uno se mueve desde el borde exterior del núcleo hacia el centro. Esto demostró que ni siquiera el N 2 H + es un trazador ideal para la química de los núcleos preestelares densos y concluyó que el H 2 D + puede ser la única buena sonda molecular de las regiones más internas de los núcleos preestelares. [10]

Aunque los astrónomos observan con mayor frecuencia el N 2 H + debido a su facilidad de detección, ha habido algunos experimentos de laboratorio que lo han observado en un ambiente más controlado. El primer espectro de laboratorio de N 2 H + era de la banda rotacional 1-0 en el nivel vibratorio del suelo, la misma transición de microondas que los astrónomos habían descubierto recientemente en el espacio. [11]
Diez años después, Owrutsky et al. realizaron espectroscopia vibratoria de N 2 H + observando el plasma creado por una descarga de una mezcla de nitrógeno, hidrógeno y gas argón utilizando un láser central de color. Durante la descarga pulsada, los polos se invirtieron en pulsos alternos, por lo que los iones fueron arrastrados hacia adelante y hacia atrás a través de la celda de descarga. Esto provocó que las características de absorción de los iones, pero no las moléculas neutras, se desplazaran hacia adelante y hacia atrás en el espacio de frecuencia, por lo que se podría usar un amplificador de bloqueo para observar los espectros solo de los iones en la descarga. El bloqueo combinado con la modulación de velocidad dio >99,9% de discriminación entre iones y neutros. El gas de alimentación se optimizó para la producción de N 2 H + , y se observaron transiciones hasta J = 41 tanto para la banda de estiramiento fundamental N – H como para la banda caliente de flexión. [12]
Posteriormente, Kabbadj et al. observaron bandas aún más calientes asociadas con la banda vibratoria fundamental utilizando un láser de frecuencia diferente para observar una descarga de una mezcla de gases de nitrógeno, hidrógeno y helio. Usaron modulación de velocidad de la misma manera que Owrutsky et al. tenía, para discriminar iones de neutros. Combinaron esto con una técnica de haz contrapropagante para ayudar en la sustracción de ruido, y esto aumentó considerablemente su sensibilidad. Tenían suficiente sensibilidad para observar OH + , H2O + y H3O + que se formaban a partir de las diminutas impurezas de O2 y H2O en su tanque de helio . [13]

Al ajustar todas las bandas observadas, se determinó que las constantes de rotación para N 2 H + eran B e = 1,561928 cm −1 y D e =2,746 × 10 −6 cm −1 , que son las únicas constantes necesarias para determinar el espectro rotacional de esta molécula lineal en el estado vibratorio fundamental, con la excepción de determinar la división hiperfina. Dada la regla de selección Δ J = ±1, se pueden trazar los niveles de energía rotacional calculados, junto con su porcentaje de población a 30 kelvin . Las frecuencias de los picos predichas por este método difieren de las observadas en el laboratorio en como máximo 700 kHz.
El N 2 H + se encuentra principalmente en densas nubes moleculares, donde su presencia está estrechamente relacionada con la de muchos otros compuestos que contienen nitrógeno. [14] Está particularmente ligado a la química del N 2 , que es más difícil de detectar (ya que carece de momento dipolar). Esta es la razón por la que el N 2 H + se utiliza comúnmente para determinar indirectamente la abundancia de N 2 en las nubes moleculares.
Las velocidades de las reacciones dominantes de formación y destrucción pueden determinarse a partir de constantes de velocidad conocidas y abundancias fraccionarias (en relación con el H2 ) en una nube molecular densa típica. [15] Las tasas calculadas aquí fueron para tiempos tempranos (316.000 años) y una temperatura de 20 kelvin, que son condiciones típicas para una nube molecular relativamente joven.
Hay docenas de reacciones posibles, pero éstas son las únicas que son lo suficientemente rápidas como para afectar la abundancia de N 2 H + en densas nubes moleculares. Por tanto, el diazenilo desempeña un papel fundamental en la química de muchas moléculas que contienen nitrógeno. [14] Aunque la densidad electrónica real en las llamadas "nubes densas" es bastante baja, la destrucción de N 2 H + se rige principalmente por la recombinación disociativa .