El dióxido de uranio u óxido de uranio (IV) ( UO 2 ) , también conocido como urania u óxido uranoso , es un óxido de uranio y es un polvo cristalino , radioactivo y negro que se encuentra naturalmente en el mineral uraninita . Se utiliza en barras de combustible nuclear en reactores nucleares . Como combustible MOX se utiliza una mezcla de dióxidos de uranio y plutonio . Antes de 1960, se utilizaba como color amarillo y negro en esmaltes cerámicos y vidrio.
El dióxido de uranio se produce reduciendo el trióxido de uranio con hidrógeno .
Esta reacción juega un papel importante en la creación de combustible nuclear mediante el reprocesamiento nuclear y el enriquecimiento de uranio .
El sólido es isoestructural con (tiene la misma estructura que) fluorita ( fluoruro de calcio ), donde cada U está rodeada por ocho O vecinos más cercanos en una disposición cúbica. Además, los dióxidos de cerio , torio y los elementos transuránicos desde neptunio hasta californio tienen las mismas estructuras. [3] Ningún otro dióxido elemental tiene la estructura de fluorita. Al fundirse, la coordinación media de UO medida se reduce de 8 en el sólido cristalino (UO 8 cubos) a 6,7 ± 0,5 (a 3270 K) en la masa fundida. [4] Los modelos consistentes con estas mediciones muestran que la masa fundida consiste principalmente en unidades poliédricas UO 6 y UO 7 , donde aproximadamente 2 ⁄ 3 de las conexiones entre poliedros comparten esquinas y 1 ⁄ 3 comparten bordes. [4]
El dióxido de uranio se oxida en contacto con el oxígeno formando octaóxido de triuranio .
La electroquímica del dióxido de uranio se ha investigado en detalle, ya que la corrosión galvánica del dióxido de uranio controla la velocidad a la que se disuelve el combustible nuclear usado . Consulte combustible nuclear gastado para obtener más detalles. El agua aumenta la tasa de oxidación de los metales plutonio y uranio. [5] [6]
El dióxido de uranio se carboniza en contacto con el carbono , formando carburo de uranio y monóxido de carbono .
Este proceso debe realizarse bajo un gas inerte , ya que el carburo de uranio se oxida fácilmente y se convierte en óxido de uranio .
El UO 2 se utiliza principalmente como combustible nuclear , concretamente como UO 2 o como una mezcla de UO 2 y PuO 2 ( dióxido de plutonio ) denominada óxido mixto ( combustible MOX ), en forma de barras de combustible en los reactores nucleares .
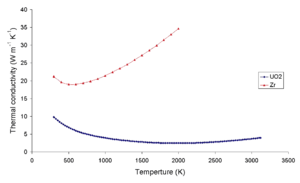
La conductividad térmica del dióxido de uranio es muy baja en comparación con el uranio , el nitruro de uranio , el carburo de uranio y el material de revestimiento de circonio . Esta baja conductividad térmica puede provocar un sobrecalentamiento localizado en el centro de las pastillas de combustible. El siguiente gráfico muestra los diferentes gradientes de temperatura en diferentes compuestos de combustible. Para estos combustibles, la densidad de potencia térmica es la misma y el diámetro de todos los pellets es el mismo. [ cita necesaria ]
El óxido de uranio (urania) se utilizaba para colorear vidrio y cerámica antes de la Segunda Guerra Mundial, y hasta que se descubrieron las aplicaciones de la radiactividad este era su uso principal. En 1958, los militares tanto de Estados Unidos como de Europa permitieron nuevamente su uso comercial como uranio empobrecido, y su uso comenzó nuevamente en una escala más limitada. Los esmaltes cerámicos a base de urania son de color verde oscuro o negro cuando se cuecen en reducción o cuando se utiliza UO 2 ; más comúnmente se usa en oxidación para producir esmaltes de color amarillo brillante, naranja y rojo. [7] Fiestaware de color naranja es un ejemplo bien conocido de un producto con un esmalte de color urania. El vidrio de uranio es de color verde pálido a amarillo y, a menudo, tiene fuertes propiedades fluorescentes. La urania también se ha utilizado en formulaciones de esmalte y porcelana . Es posible determinar con un contador Geiger si un vidriado o vidrio producido antes de 1958 contiene urania.
Antes de que se descubriera la nocividad de la radiación, el uranio se incluía en dentaduras postizas y dentaduras postizas, ya que su ligera fluorescencia hacía que las dentaduras postizas parecieran más dientes reales en una variedad de condiciones de iluminación. [ cita necesaria ]
El UO 2 empobrecido (DUO 2 ) se puede utilizar como material de protección contra la radiación . Por ejemplo, DUCRETE es un material de " hormigón pesado " donde la grava se reemplaza con agregado de dióxido de uranio; Este material está siendo investigado para su uso en contenedores de residuos radiactivos . Los contenedores también pueden estar hechos de cermet de acero DUO 2 , un material compuesto hecho de un agregado de dióxido de uranio que sirve como protección contra la radiación, grafito y/o carburo de silicio que sirve como absorbente y moderador de la radiación de neutrones , y acero como matriz, cuya alta temperatura La conductividad permite una fácil eliminación del calor de descomposición. [ cita necesaria ]
El dióxido de uranio empobrecido también se puede utilizar como catalizador , por ejemplo, para la degradación de compuestos orgánicos volátiles en fase gaseosa, la oxidación de metano a metanol y la eliminación de azufre del petróleo . Tiene alta eficiencia y estabilidad a largo plazo cuando se usa para destruir COV en comparación con algunos de los catalizadores comerciales , como los catalizadores de metales preciosos , TiO 2 y Co 3 O 4 . Se están realizando muchas investigaciones en esta área, prefiriéndose el DU para el componente de uranio debido a su baja radiactividad. [8]
Se está investigando el uso de dióxido de uranio como material para baterías recargables . Las baterías podrían tener una alta densidad de potencia y un potencial de 4,7 V por celda. Otra aplicación investigada es la de las células fotoelectroquímicas para la producción de hidrógeno asistida por energía solar, donde se utiliza UO 2 como fotoánodo . Antiguamente el dióxido de uranio también se utilizaba como conductor térmico para limitar la corriente (resistencia URDOX), siendo este el primer uso de sus propiedades semiconductoras. [ cita necesaria ]
El dióxido de uranio muestra un fuerte piezomagnetismo en estado antiferromagnético , observado a temperaturas criogénicas por debajo de 30 kelvin . En consecuencia, la magnetoestricción lineal encontrada en UO 2 cambia de signo con el campo magnético aplicado y exhibe fenómenos de conmutación de memoria magnetoelástica en campos de conmutación récord de 180.000 Oe. [9] El origen microscópico de las propiedades magnéticas del material radica en la simetría de la red cristalina cúbica centrada en las caras de los átomos de uranio y su respuesta a los campos magnéticos aplicados. [10]
La banda prohibida del dióxido de uranio es comparable a las del silicio y el arseniuro de galio , cerca de la curva óptima de eficiencia versus banda prohibida para la absorción de radiación solar, lo que sugiere su posible uso para células solares muy eficientes basadas en la estructura del diodo Schottky ; también absorbe en cinco longitudes de onda diferentes, incluida la infrarroja, lo que mejora aún más su eficiencia. Su conductividad intrínseca a temperatura ambiente es aproximadamente la misma que la del silicio monocristalino . [11]
La constante dieléctrica del dióxido de uranio es de aproximadamente 22, que es casi el doble que la del silicio (11,2) y el GaAs (14,1). Esta es una ventaja sobre el Si y GaAs en la construcción de circuitos integrados , ya que puede permitir una integración de mayor densidad con voltajes de ruptura más altos y con menor susceptibilidad a la ruptura del túnel CMOS .
El coeficiente de Seebeck del dióxido de uranio a temperatura ambiente es de unos 750 µV/K, un valor significativamente superior a los 270 µV/K del telururo de talio y estaño (Tl 2 SnTe 5 ) y del telururo de talio y germanio (Tl 2 GeTe 5 ) y del bismuto . aleaciones de telurio , otros materiales prometedores para aplicaciones de generación de energía termoeléctrica y elementos Peltier .
En 2005 no se había medido el impacto de la desintegración radiactiva de las 235 U y 238[actualizar] U sobre sus propiedades semiconductoras . Debido a la lenta tasa de desintegración de estos isótopos, no debería influir significativamente en las propiedades de las células solares de dióxido de uranio y los dispositivos termoeléctricos, pero puede convertirse en un factor importante para los chips VLSI . Por este motivo es necesario el uso de óxido de uranio empobrecido . La captura de partículas alfa emitidas durante la desintegración radiactiva como átomos de helio en la red cristalina también puede provocar cambios graduales a largo plazo en sus propiedades. [ cita necesaria ]
La estequiometría del material influye dramáticamente en sus propiedades eléctricas. Por ejemplo, la conductividad eléctrica de UO 1.994 es órdenes de magnitud menor a temperaturas más altas que la conductividad de UO 2.001 [ cita necesaria ] .
El dióxido de uranio, al igual que el U 3 O 8 , es un material cerámico capaz de soportar altas temperaturas (alrededor de 2.300 °C, en comparación con los 200 °C como máximo del silicio o el GaAs), lo que lo hace adecuado para aplicaciones de alta temperatura como los dispositivos termofotovoltaicos.
El dióxido de uranio también es resistente al daño por radiación , lo que lo hace útil para dispositivos resistentes a la radiación para aplicaciones militares y aeroespaciales especiales .
En un laboratorio se fabricaron con éxito un diodo Schottky de U 3 O 8 y un transistor pnp de UO 2 . [12]
Se sabe que el dióxido de uranio se absorbe mediante fagocitosis en los pulmones. [13]
{{cite journal}}: Citar diario requiere |journal=( ayuda )