El acoplamiento oxidativo de fenoles es una reacción química en la que dos compuestos fenólicos se acoplan mediante un proceso oxidativo . Los acoplamientos oxidativos de fenol a menudo son catalizados por complejos de metales de transición que incluyen V , Cr , Mn , Cu , Fe , entre otros. Estas reacciones a menudo forman enlaces C – C o C – O entre los socios de acoplamiento y pueden emplearse como homoacoplamientos o cruzados . [1]
Un ejemplo representativo es la reacción del fenol con una solución de tetracloruro de vanadio , que produce aproximadamente un 60% de rendimiento de tres compuestos dihidroxibifenílicos isoméricos. La relación de isómeros y los rendimientos no se ven afectados por la relación reactivo/sustrato. Se sabe que el tetracloruro de vanadio efectúa oxidaciones de un electrón, lo que se invoca en esta conversión. [2]

Los acoplamientos oxidativos de fenol pueden ocurrir a través de procesos de esfera interna o externa . En los procesos de esfera interna, el sustrato fenólico se coordina con el centro metálico para dar un complejo de fenóxido. La oxidación al fenóxido se produce mediante transferencia de electrones o abstracción de átomos de hidrógeno. El intermedio reactivo resultante puede participar en procesos químicos posteriores que pueden ocurrir a través de socios de acoplamiento coordinados (esfera interna) o no coordinados.

Las reacciones radical-radical son fáciles de imaginar pero poco probables, ya que requieren la coexistencia de dos radicales de larga vida. En cambio, el radical fenol o fenoxi se suma a otro fenol o fenóxido. Al proceso inicial de formación del enlace CC le sigue la abstracción y tautomerización del átomo de hidrógeno.
Los acoplamientos en los que no intervienen catalizadores metálicos se desarrollan generalmente mediante el mecanismo radical-fenol. [3] [4] [5]
Aunque se conocen ejemplos selectos de homoacoplamientos asimétricos, su diseño es notoriamente difícil y a menudo se llega a ellos de manera empírica.
Los acoplamientos oxidativos de fenol asimétricos enantioselectivos aún no están bien establecidos ni son generales; sin embargo, existen informes que aprovechan catalizadores de vanadio asimétricos para homoacoplar fenoles enantioselectivamente. Por el contrario, se ha avanzado mucho en los acoplamientos asimétricos de 2-naftol utilizando catalizadores de Ru , Cu, V y Fe, [6] que han tenido un gran impacto en el desarrollo de ligandos tipo BINAP utilizados en catálisis asimétrica.
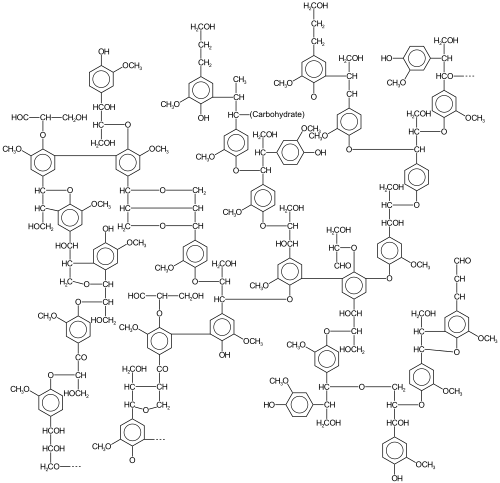
La lignina , un polifenol que se encuentra en la mayoría de las plantas, es una forma muy abundante de biomasa que surge, en parte, por acoplamiento oxidativo de fenoles. Las ligninas son particularmente importantes en la formación de las paredes celulares , especialmente en la madera y la corteza , porque aportan rigidez y no se pudren fácilmente. Químicamente, las ligninas son polímeros obtenidos mediante la reticulación de precursores fenólicos . [7]

El primer ejemplo de un acoplamiento oxidativo de fenol en la química sintética se remonta a la síntesis de ácido elágico de Julius Löwe en 1868, lograda calentando ácido gálico con ácido arsénico. [8]
En la síntesis de compuestos orgánicos complejos , a veces se emplean acoplamientos oxidativos de fenol. La reacción es atractiva para su economía atómica porque evita los materiales de partida prefuncionalizados que a menudo se requieren en los acoplamientos cruzados redox-neutrales tradicionales. Sin embargo, los acoplamientos oxidativos de fenol a menudo sufren de sobreoxidación, especialmente porque el producto acoplado previsto es más oxidable (tiene un potencial de oxidación más bajo ) que el material de partida. En tales casos, el catalizador puede apagarse o envenenarse participando en procesos redox fuera de ciclo con el producto. Además, el producto puede oxidarse aún más, dando paso a oligómeros de orden superior .
Pueden surgir problemas de selectividad durante los acoplamientos oxidativos de fenol entre productos acoplados C – C y acoplados C – O. [9] Además, la estereoselectividad es una consideración importante si el compuesto de bifenol resultante muestra quiralidad axial o atropoisomerismo . Se debe considerar la selectividad entre productos homo y heteroacoplados, y a menudo se puede abordar mediante catálisis de metales de transición.

Los acoplamientos oxidativos de fenol intramoleculares se conocen desde hace mucho tiempo. Los ejemplos mejor estudiados de tales transformaciones son aquellos que producen productos acoplados de fenol-dienona espirocíclico. Los socios de acoplamiento en un acoplamiento intramolecular deben acercarse en una disposición casi paralela para permitir la superposición orbital; [10] estas estrictas restricciones geométricas sobre los compuestos preciclados a menudo hacen que el proceso sea lento, si es posible. [11]

Las lacasas a menudo efectúan acoplamientos oxidativos, formando a veces enlaces CO. [12]
El acoplamiento selectivo C-O de fenoles está representado por pocos ejemplos en química sintética. [13] En muchos casos, el acoplamiento selectivo C-O solo se puede lograr si todas las posiciones orto y para en el areno están bloqueadas. [14] La pobre selectividad del acoplamiento C-O probablemente se deba a la falta de densidad de espín de los radicales en el oxígeno después de la oxidación del fenol, lo que resulta en un atrapamiento cinético de los productos del acoplamiento C-C.
También se han estudiado los acoplamientos oxidativos entre fenoles y compuestos no fenólicos, incluidas anilinas, beta-cetoésteres/malonatos/malononitrilos, arenos ricos en electrones, olefinas y otros grupos funcionales. [1]