Las reacciones de acoplamiento cruzado descarboxilativo son reacciones químicas en las que un ácido carboxílico reacciona con un haluro orgánico para formar un nuevo enlace carbono-carbono, lo que conlleva la pérdida de CO2 . Participan haluros de arilo y alquilo . Se requieren catalizador metálico , base y oxidante .
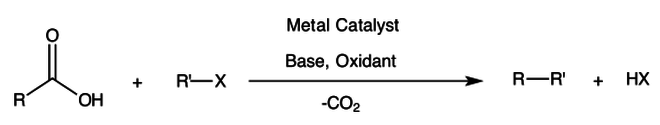
Una ventaja significativa de esta reacción es que utiliza ácidos carboxílicos relativamente económicos (o sus sales) y es mucho menos sensible al aire y la humedad en comparación con los reactivos organometálicos de acoplamiento cruzado típicos . Además, la fracción de ácido carboxílico es una característica común de los productos naturales y también se puede preparar mediante oxidaciones de aire relativamente benignas . Los beneficios adicionales incluyen la amplia tolerancia de los grupos funcionales , así como la capacidad de evitar el uso de bases fuertes . Un paso elemental importante en esta reacción es la protodescarboxilación o metalación para convertir primero el enlace C–COOH en un enlace C–H o C–M respectivamente. [1]
La primera reacción de acoplamiento cruzado descarboxilativo descrita fue una reacción de Ullmann , en 1966 por Nilsson et al. Se descubrió que la descarboxilación térmica de benzoatos de cobre, en presencia de un haluro de arilo , produce biarilos (tanto simétricos como asimétricos) a través de intermediarios de aril-Cu. [2]

Este sistema de cobre monometálico requería condiciones drásticas para un acoplamiento cruzado completo y tenía varias limitaciones intrínsecas, las cuales impedían el desarrollo de una versión catalítica preparatoria de esta reacción. [3] No fue hasta 2009 que Liu y Shang et al. descubrieron que el acoplamiento cruzado descarboxilativo de bromuros y yoduros de arilo con polifluorobenzoatos de potasio podía lograrse utilizando yoduro de cobre monometálico como catalizador. Se determinó que el paso de adición oxidativa era el paso limitante de la velocidad en el ciclo del catalizador solo de cobre (un contraste con el acoplamiento cruzado descarboxilativo catalizado por Pd). [4]
También se ha descubierto que los sistemas de solo Cu(I) promueven el acoplamiento de ácidos carboxílicos alquinílicos con haluros de arilo (ver aril alquinos a continuación), así como el acoplamiento cruzado descarboxilativo deshidrogenativo de aminoácidos con alquinos (o nucleófilos similares ). [5] [6]
Los catalizadores para el acoplamiento cruzado descarboxilativo son de la forma general ML2, con una amplia variedad de tipos de ligandos optimizados para diferentes sustratos. Los centros de cobre (y plata) a menudo se encuentran en complejos con fenantrolinas y se informa que la actividad aumenta con sustituyentes ricos en electrones en los ligandos. [1]
En 2000, Steglich et al. informaron sobre una reacción de acoplamiento cruzado descarboxilativo mediada por Pd(II) intramolecular en su síntesis de lamelarina L. [7] Myers et al. informaron sobre la olefinación descarboxilativa de carboxilatos de areno orto -sustituidos en presencia de un oxidante (Ag2CO3) en 2002. [8]
Estudios posteriores demostraron que los catalizadores de Pd homogéneos eran capaces de descarboxilar ácidos a temperaturas más bajas que sus homólogos de Cu y Ag, pero estaban limitados a ácidos carboxílicos aromáticos orto -sustituidos ricos en electrones. [9] [10] A pesar de esto, los catalizadores de paladio pueden promover una amplia variedad de reacciones de acoplamiento cruzado, incluyendo la formación de biarilo y la formación de aril alquino, junto con una variedad de reacciones de acoplamiento cruzado en las que el ácido carboxílico no está unido a un aromático. [5] [11] [12] Otras reacciones de acoplamiento cruzado de descarboxilación catalizadas por Pd incluyen la preparación de dienos conjugados (ver dienos y trienos a continuación) y reacciones deshidrogenativas (con una variedad de combinaciones de sustrato y catalizador ). [1] [13]
A diferencia de los sistemas que contienen solo Cu, la paladación descarboxilativa es el paso limitante de la velocidad en el ciclo catalítico del paladio. [4]
Un sistema bimetálico Pd-Cu no fue descubierto hasta 2006, cuando Goossen et al. informaron sobre un acoplamiento cruzado descarboxilativo de haluros de arilo con ácidos carboxílicos aromáticos sustituidos en orto . [14] A través de estudios posteriores se encontró que el uso de triflatos de arilo permitió que el alcance del sustrato para el acoplamiento cruzado se extendiera a algunos carboxilatos aromáticos que carecen de cualquier sustitución en orto (menos reactivos). Esto fue el resultado del hecho de que cualquier anión haluro generado en la reacción inhibió el proceso de descarboxilación catalizado por Cu. [15] Una mayor optimización del sistema y las condiciones del catalizador han hecho que el acoplamiento cruzado descarboxilativo utilizando sistemas bimetálicos Pd-Cu sea aplicable a la síntesis orgánica, más predominantemente en la formación de biarilos. [3] Además, la variabilidad de este sistema catalítico combinado permite la promoción de un amplio espectro de reacciones, incluida la formación de arilcetona, el acoplamiento cruzado de c-heteroátomos y muchas otras. [1]
La plata está en el mismo grupo que el cobre, por lo que los sistemas bimetálicos Pd–Ag(I) son inherentemente similares a los sistemas catalíticos Pd–Cu . Sin embargo, las sales de plata son más adecuadas para la protodescarboxilación de ácidos carboxílicos que sus equivalentes de cobre, lo que permite condiciones de reacción más suaves en los ciclos Pd–Ag en relación con los ciclos Pd–Cu. [16] También se han informado sistemas monometálicos catalizados por Ag(I). Su competencia (en relación con el cobre) probablemente se atribuya a una menor electronegatividad y una mayor expansión de los orbitales d , que promueven la descarboxilación del sustrato. [17] Una limitación de esta combinación de catalizadores es que las sales de plata formarán haluros de plata insolubles, lo que obligará a la reacción a requerir una cantidad estequiométrica de Ag si hay haluros presentes. Este obstáculo fue superado por Goossen et al. en 2010 mediante el uso de triflatos de arilo, y también se ha informado de una reacción catalítica con sulfonatos de arilo. [3] [18]
El alcance del producto de esta reacción es extremadamente amplio con el uso de diferentes sustratos; sin embargo, el desarrollo de diferentes funcionalidades ha requerido estudios acompañados para determinar el sistema catalizador adecuado. La clase más típica de reacciones implica el acoplamiento entre enlaces C–COOH y C–X, sin embargo, el acoplamiento cruzado C–COOH y C–M, el homoacoplamiento de ácidos carboxílicos, el acoplamiento heck y el acoplamiento cruzado deshidrogenativo también pueden incluirse en esta clase, ya que liberan CO 2 . También se han demostrado reacciones de acoplamiento cruzado de heteroátomos que implican la formación de enlaces C–N, C–S, C–P y C–X. [1]
Según la IUPAC, el término biarilo se refiere a un conjunto de dos anillos aromáticos unidos por un enlace simple, [19] comenzando con el más simple, el bifenilo . Los biarilos constituyen un motivo estructural importante de interés físico orgánico, sintético y catalítico (por ejemplo, en el área de los atropisómeros en la síntesis enantioselectiva ) y aparecen en muchas aplicaciones farmacéuticas, agroquímicas y de materiales (por ejemplo, LCD). [ cita requerida ] El ejemplo de una reacción de acoplamiento utilizada en su preparación es una alternativa a las reacciones tradicionales de acoplamiento cruzado de Suzuki y Stille, y se han empleado varios catalizadores para esta transformación; Goossen et al. informaron sobre la formación de biarilos a partir de reacciones de acoplamiento cruzado catalizadas por paladio y cobre de un ácido carboxílico arílico o heteroarílico y un haluro de arilo (I, Br o Cl) en presencia de una base. [20]

Los aril alquinos se obtienen típicamente utilizando la reacción de Sonogashira, que es la reacción de acoplamiento cruzado catalizada por paladio de alquinos terminales y haluros de arilo. En lugar de los alquinos terminales, los ácidos carboxílicos de alquino tienen ventajas, como un fácil manejo y almacenamiento. El primer acoplamiento descarboxilativo de ácidos carboxílicos de alquino fue informado en 2008 por S. Lee. Emplearon ácido propiólico como fuente de alquino. Un año después, S. Lee aplicó las reacciones de acoplamiento descarboxilativo hacia el ácido 2-octinoico y el ácido fenilpropiólico. En 2010, Xue et al. informaron sobre el acoplamiento de un haluro de arilo y un ácido carboxílico de alquinilo en condiciones de reacción suaves y un catalizador de solo cobre para obtener aril alquinos.
[21] [22] [23] [24]

Trabajos posteriores de Goossen et al. describieron la síntesis de cetonas a partir de ácidos α-oxocarboxílicos con bromuros de arilo o heteroarilo a través de un intermedio de anión acilo. [25]

Shang et al. descubrieron el acoplamiento descarboxilativo de monoésteres de oxalato de potasio con haluros de arilo para obtener ésteres de arilo o alquenilo. [5]

Muchas reacciones de acoplamiento cruzado descarboxilativo implican la ruptura de enlaces sp 2 C–COOH y sp C–COOH, por lo que estudios posteriores han intentado permitir el acoplamiento cruzado con ácidos carboxílicos sp 3 C. Una de esas reacciones de Shang et al. describió un acoplamiento cruzado catalizado por paladio que permite la formación de piridinas, pirazinas, quinolinas, benzotiazoles y benzoxazoles funcionalizados. Se encontró que la posición del átomo de nitrógeno en la posición '2' en relación con el enlace es necesaria, lo que implica su unión a Pd en un estado de transición. [26]

Miura et al. informaron sobre el acoplamiento cruzado de bromuros de vinilo con un ácido carboxílico alquenílico utilizando un catalizador de paladio. Se informó que algunos de los dienos conjugados preparados exhibieron fluorescencia en estado sólido. [27]

Se puede utilizar un acoplamiento Heck descarboxilativo de Su et al. para obtener una arilolefina utilizando benzoquinona como oxidante. [28]

Wang et al. propusieron un nuevo método para la anulación [4+2] a través de una vía intermolecular catalizada por paladio. Los derivados se forman con un rendimiento moderado a bueno; la acridina es esencial para una alta eficiencia de reacción. [29]

Jiao et al. lograron la formación de un enlace C–N mediante acoplamiento cruzado utilizando aire como oxidante y un catalizador de cobre. No se conocen condiciones para un acoplamiento cruzado C–N que rompa un enlace C–COOH sp3 o sp2 . [30]

Liu et al. informaron sobre el acoplamiento CS de ácidos carboxílicos arílicos con disulfuros o tioles utilizando un sistema catalizador de Pd/Cu. [31]

Utilizando catalizadores de Pd-Cu o Cu, Yang et al. informaron el primer ejemplo de acoplamiento cruzado C-P descarboxilativo. [32]

Wu et al. informaron sobre un acoplamiento cruzado C–X utilizando CuX 2 (X = Br, Cl) y un catalizador de plata para obtener haluros de arilo. [33]

En 2005, Meyers et al. propusieron el siguiente mecanismo para la reacción de acoplamiento cruzado descarboxilativo. [10] El paso inicial y determinante de la velocidad es la descarboxilación. Se cree que el carbono ipso del anillo de areno se coordina inicialmente con el centro de paladio y es seguido por la expulsión de dióxido de carbono, formando un intermedio de arilo-paladio. La olefina luego se inserta entre el centro de areno y paladio, que luego sufre una eliminación beta para formar el haluro de vinilo deseado, así como un hidruro de paladio. Este protón es abstraído por carbonato de plata, que actúa como base y oxidante para regenerar el complejo de paladio inicial, completando así el ciclo catalítico.
En 2006, Goossen et al. propusieron una reacción para sintetizar compuestos de biarilo mediante acoplamiento cruzado descarboxilativo catalítico. [34] El mecanismo implica dos ciclos superpuestos, uno que utiliza un haluro de cobre y el otro que utiliza paladio. El paso de descarboxilación ocurre entre el ácido benzoico sustituido y el haluro de cobre para formar la especie intermedia de arilo de cobre. El paladio inicialmente sufre una adición oxidativa del haluro de arilo para formar un complejo de arilo Pd(II). Después de estos dos pasos iniciales, el arilo de cobre sustituido sufre una transmetalación con el complejo de paladio. Este paso forma el haluro de cobre, que luego sufre un intercambio aniónico con el ácido benzoico sustituido para reformar el intermedio de arilo de cobre, continuando el ciclo catalítico. El otro complejo formado en el paso de transmetalación es un bis-aril paladio(II), que luego sufre una eliminación reductora para formar la especie de bis-arilo deseada, así como el complejo de Pd(0) de partida, completando así el ciclo catalítico.
Forgione, P., Bilodeau, F. et al. informaron que los heteroátomos que contienen un ácido carboxílico también son tolerados por los sistemas monometálicos de paladio y experimentan un acoplamiento cruzado descarboxilativo con haluros de arilo. [35] En el mecanismo propuesto, el paso inicial es la adición oxidativa del haluro de arilo formando un intermedio arilo-paladio. Luego, se produce la paladación electrofílica en el carbono 3 del heteroátomo. A partir de este intermedio, hay dos posibles vías para que continúe el ciclo. La primera es la migración de paladio del carbono 3 al carbono 2 junto con la expulsión de dióxido de carbono. Esto forma el intermedio arilo-paladio-heteroátomo, que experimenta una eliminación reductora para formar el compuesto heteroaromático final. La segunda vía solo ocurre cuando R es un protón. Si este es el caso, se produce una desprotonación para recuperar la aromaticidad del heteroátomo. Luego, este intermedio sufre una eliminación reductora, acoplando el arilo a la posición de carbono 3 del heteroátomo. Como este compuesto todavía contiene el ácido carboxílico, queda libre para volver a entrar en el ciclo catalítico, donde se acopla en la posición del carbono 2, junto con la expulsión de dióxido de carbono para formar un heteroátomo de biarilo. Como esta vía compite con el paso de descarboxilación, se forman dos productos que hacen que esta reacción sea menos selectiva. Como resultado, los heteroátomos, que se sustituyen en la posición del carbono 3, son más favorecidos debido al mayor nivel de control que proporcionan.