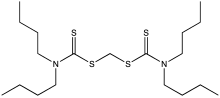
En química orgánica , un ditiocarbamato es un grupo funcional con la fórmula general R 2 N−C(=S)−S−R y estructura >N−C(=S)−S− . Es el análogo de un carbamato en el que ambos átomos de oxígeno son reemplazados por átomos de azufre (cuando solo se reemplaza 1 oxígeno el resultado es tiocarbamato ).
El ditiocarbamato también se refiere al ion ditiocarbamato R 2 N−CS−2y sus sales. Un ejemplo común es el dietilditiocarbamato de sodio . Los ditiocarbamatos y sus derivados se utilizan ampliamente en la vulcanización del caucho. [1]
Muchas aminas secundarias reaccionan con disulfuro de carbono e hidróxido de sodio para formar sales de ditiocarbamato: [2]
El amoniaco reacciona con CS2 de manera similar:
Las sales de ditiocarbamato son sólidos de color pálido que son solubles en agua y disolventes orgánicos polares.
Una amina primaria y disulfuro de carbono reaccionan para dar un ácido ditiocarbámico :
En presencia de diimidas o piridina, estos ácidos se convierten en isotiocianatos : [3]
Los ditiocarbamatos se alquilan fácilmente en S. Por lo tanto, el dimetilditiocarbamato de metilo se puede preparar mediante metilación del ditiocarbamato: [4]
La oxidación de ditiocarbamatos produce disulfuro de tiuram :
Los disulfuros de tiuram reaccionan con reactivos de Grignard para dar ésteres de ácido ditiocarbámico: [5]
Los ditiocarbamatos reaccionan con sales de metales de transición para dar una amplia variedad de complejos de ditiocarbamatos de metales de transición .
Los ditiocarbamatos se describen invocando estructuras de resonancia que enfatizan las propiedades de donador de pi del grupo amina. Esta disposición de enlace se indica mediante una distancia corta C-N y la coplanaridad del núcleo NCS2, así como de los átomos unidos a N. [6]

Debido a la pi-donación del nitrógeno, los ditiocarbamatos son más básicos que los aniones estructuralmente relacionados, como los ditiocarboxilatos y los xantatos . En consecuencia, tienden a unirse como ligandos bidentados . Otra consecuencia del enlace múltiple C–N es que la rotación alrededor de ese enlace está sujeta a una alta barrera.
Existen varios complejos de ditiocarbamatos de metales de transición que son útiles en la industria. Los ditiocarbamatos de zinc se utilizan para modificar la reticulación de ciertas poliolefinas con azufre, un proceso llamado vulcanización . Se utilizan como ligandos para la quelación de metales. [7]

Algunos ditiocarbamatos, específicamente los bisditiocarbamatos de etileno (Los EBDCs ), en forma de complejos con manganeso ( maneb ), zinc ( zineb ) o una combinación de manganeso y zinc ( mancozeb ), se han utilizado ampliamente como fungicidas en la agricultura desde la década de 1940. [8] En los Estados Unidos comenzaron a registrarse para su uso a fines de la década de 1950 y principios de la de 1960 y rápidamente se pusieron a trabajar en la mancha de hollín y la mancha de mosca . [9] Muchos productores cambiaron de captan a EBDCs por el período residual más largo. [9] Tanto el captan como los EBDC fueron los tratamientos primarios para SBFS en ese país hasta principios de la década de 1990, cuando la Agencia de Protección Ambiental de los EE. UU. prohibió los EBDC dentro de los 77 días posteriores a la cosecha. [9] Esto efectivamente hizo imposible el uso de verano, redujo el uso de EBDC en general y aumentó radicalmente el SBFS. [9]