
La cristalización de proteínas es el proceso de formación de una matriz regular de moléculas proteicas individuales estabilizadas por el contacto entre cristales. Si el cristal está suficientemente ordenado, se difractará . Algunas proteínas forman matrices cristalinas de forma natural, como la acuaporina en el cristalino del ojo. [1] [2]
En el proceso de cristalización de proteínas, las proteínas se disuelven en un entorno acuoso y una solución de muestra hasta que alcanzan el estado sobresaturado . [3] Se utilizan diferentes métodos para alcanzar ese estado, como la difusión de vapor, microlotes, microdiálisis y difusión de interfaz libre. El desarrollo de cristales de proteínas es un proceso difícil influenciado por muchos factores, incluidos el pH, la temperatura, la fuerza iónica en la solución de cristalización e incluso la gravedad. [3] Una vez formados, estos cristales se pueden utilizar en biología estructural para estudiar la estructura molecular de la proteína, particularmente para varios fines industriales o médicos. [4] [5]
Desde hace más de 150 años, científicos de todo el mundo conocen la cristalización de las moléculas de proteínas. [6]
En 1840, Friedrich Ludwig Hünefeld descubrió accidentalmente la formación de material cristalino en muestras de sangre de lombriz de tierra colocadas bajo dos portaobjetos de vidrio y, ocasionalmente, observó pequeños cristales en forma de placa en muestras de sangre desecada de cerdo o de humano. Felix Hoppe-Seyler denominó a estos cristales "hemoglobina" en 1864. Los hallazgos fundamentales de Hünefeld inspiraron a muchos científicos en el futuro. [7]
En 1851, Otto Funke describió el proceso de producción de cristales de hemoglobina humana mediante la dilución de glóbulos rojos con disolventes, como agua pura, alcohol o éter, seguida de una evaporación lenta del disolvente de la solución de proteína. En 1871, William T. Preyer, profesor de la Universidad de Jena, publicó un libro titulado Die Blutkrystalle (Los cristales de la sangre), en el que analizaba las características de los cristales de hemoglobina de unas 50 especies de mamíferos, aves, reptiles y peces. [7]
En 1909, el fisiólogo Edward T. Reichert, junto con el mineralogista Amos P. Brown, publicó un tratado sobre la preparación, fisiología y caracterización geométrica de los cristales de hemoglobina de varios cientos de animales, incluidas especies extintas como el lobo de Tasmania. [7] Se encontraron cristales de proteína cada vez más numerosos.
En 1934, John Desmond Bernal y su estudiante Dorothy Hodgkin descubrieron que los cristales de proteínas rodeados de su licor madre daban mejores patrones de difracción que los cristales secos. Utilizando pepsina , fueron los primeros en discernir el patrón de difracción de una proteína húmeda y globular. Antes de Bernal y Hodgkin, la cristalografía de proteínas solo se había realizado en condiciones secas con resultados inconsistentes y poco confiables. Este es el primer patrón de difracción de rayos X de un cristal de proteína. [8]
En 1958, John Kendrew informó por primera vez la estructura de la mioglobina (una proteína roja que contiene hemo), determinada mediante cristalografía de rayos X. [9] Kendrew compartió el Premio Nobel de Química de 1962 con Max Perutz por este descubrimiento. [ 4]
Ahora bien, a partir de los cristales de proteínas, sus estructuras desempeñan un papel importante en la bioquímica y la medicina traslacional.

La cristalización de proteínas se rige por la misma física que rige la formación de cristales inorgánicos. Para que la cristalización se produzca de forma espontánea, el estado cristalino debe ser favorecido termodinámicamente. Esto se describe mediante la energía libre de Gibbs (∆G), definida como ∆G = ∆H- T∆S, que captura cómo el cambio de entalpía de un proceso, ∆H, se compensa con el cambio correspondiente en la entropía , ∆S. [10] La entropía, a grandes rasgos, describe el desorden de un sistema. Los estados altamente ordenados, como los cristales de proteínas, se ven desfavorecidos termodinámicamente en comparación con los estados más desordenados, como las soluciones de proteínas en disolventes, porque la transición a un estado más ordenado disminuiría la entropía total del sistema (∆S positiva). Para que los cristales se formen espontáneamente, la ∆G de la formación de cristales debe ser negativa. En otras palabras, la penalidad entrópica debe pagarse con una disminución correspondiente en la energía total del sistema (∆H). Los cristales inorgánicos conocidos, como el cloruro de sodio, se forman espontáneamente en condiciones ambientales porque el estado cristalino disminuye la energía total del sistema. Sin embargo, la cristalización de algunas proteínas en condiciones ambientales disminuiría la entropía (∆S positivo) y aumentaría la energía total (∆H positivo) del sistema, y por lo tanto no ocurre espontáneamente. Para lograr la cristalización de tales proteínas, se modifican las condiciones para que la formación de cristales sea energéticamente favorable. Esto a menudo se logra mediante la creación de una solución sobresaturada de la muestra. [3]
La formación de cristales requiere dos pasos: nucleación y crecimiento . [3] La nucleación es el paso de iniciación para la cristalización. [3] En la fase de nucleación, las moléculas de proteína en solución se unen como agregados para formar un núcleo sólido estable. [3] A medida que se forma el núcleo, el cristal crece cada vez más por las moléculas que se adhieren a este núcleo estable. [3] El paso de nucleación es fundamental para la formación de cristales, ya que es la transición de fase de primer orden de las muestras que pasan de tener un alto grado de libertad a obtener un estado ordenado (acuoso a sólido). [3] Para que el paso de nucleación tenga éxito, la manipulación de los parámetros de cristalización es esencial. El enfoque detrás de lograr que una proteína cristalice es producir una solubilidad menor de la proteína objetivo en solución. [3] Una vez que se excede el límite de solubilidad y hay cristales, se logra la cristalización. [3]
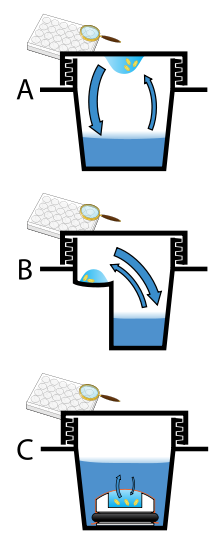
La difusión de vapor es el método más comúnmente empleado para la cristalización de proteínas. En este método, se permite que las gotitas que contienen proteína purificada, tampón y precipitante se equilibren con un reservorio más grande que contiene tampones y precipitantes similares en concentraciones más altas. Inicialmente, la gotita de solución de proteína contiene concentraciones comparativamente bajas de precipitante y proteína, pero a medida que la gota y el reservorio se equilibran, las concentraciones de precipitante y proteína aumentan en la gota. Si se utilizan las soluciones de cristalización adecuadas para una proteína dada, se produce el crecimiento de cristales en la gota. [11] [12] Este método se utiliza porque permite cambios suaves y graduales en la concentración de proteína y de precipitante, que ayudan al crecimiento de cristales grandes y bien ordenados.
La difusión de vapor se puede realizar en formato de gota colgante o gota sentada. El aparato de gota colgante implica una gota de solución de proteína colocada sobre un cubreobjetos invertido, que luego se suspende sobre el depósito. El aparato de cristalización de gota sentada coloca la gota sobre un pedestal que está separado del depósito. Ambos métodos requieren el sellado del entorno para que pueda producirse el equilibrio entre la gota y el depósito. [11] [13]
Un microbatch generalmente implica sumergir un volumen muy pequeño de gotitas de proteína en aceite (tan solo 1 μL). La razón por la que se requiere aceite es porque se utiliza un volumen tan bajo de solución de proteína y, por lo tanto, se debe inhibir la evaporación para llevar a cabo el experimento en forma acuosa. Aunque hay varios aceites que se pueden utilizar, los dos agentes de sellado más comunes son los aceites de parafina (descritos por Chayen et al.) y los aceites de silicona (descritos por D'Arcy). También hay otros métodos para el microbatching que no utilizan un agente de sellado líquido y, en su lugar, requieren que un científico coloque rápidamente una película o un poco de cinta adhesiva en una placa con pocillos después de colocar la gota en el pocillo.
Además de las cantidades muy limitadas de muestra necesarias, este método también tiene como ventaja adicional que las muestras están protegidas de la contaminación aérea, ya que nunca están expuestas al aire durante el experimento.
La microdiálisis aprovecha una membrana semipermeable , a través de la cual pueden pasar pequeñas moléculas e iones, mientras que las proteínas y los polímeros grandes no pueden hacerlo. Al establecer un gradiente de concentración de soluto a través de la membrana y permitir que el sistema avance hacia el equilibrio, el sistema puede avanzar lentamente hacia la sobresaturación, momento en el que pueden formarse cristales de proteínas.
La microdiálisis puede producir cristales mediante la adición de sal , empleando altas concentraciones de sal u otros compuestos pequeños permeables a la membrana que disminuyen la solubilidad de la proteína. En muy raras ocasiones, algunas proteínas pueden cristalizarse mediante la adición de sal mediante diálisis, dializándolas frente a agua pura, eliminando solutos, impulsando la autoasociación y la cristalización.
Esta técnica combina proteínas y soluciones de precipitación sin mezclarlas previamente, sino inyectándolas a través de ambos lados de un canal, lo que permite el equilibrio mediante difusión. Las dos soluciones entran en contacto en una cámara de reactivos, ambas en sus concentraciones máximas, lo que inicia la nucleación espontánea. A medida que el sistema alcanza el equilibrio, el nivel de sobresaturación disminuye, lo que favorece el crecimiento de los cristales. [14]
La fuerza impulsora básica para la cristalización de proteínas es optimizar el número de enlaces que uno puede formar con otra proteína a través de interacciones intermoleculares. [3] Estas interacciones dependen de las densidades electrónicas de las moléculas y las cadenas laterales de la proteína que cambian en función del pH . [10] La estructura terciaria y cuaternaria de las proteínas está determinada por interacciones intermoleculares entre los grupos laterales de los aminoácidos, en los que los grupos hidrófilos suelen estar orientados hacia afuera de la solución para formar una capa de hidratación hacia el disolvente (agua). [10] A medida que cambia el pH, la carga de estos grupos laterales polares también cambia con respecto al pH de la solución y al pKa de la proteína . Por lo tanto, la elección del pH es esencial para promover la formación de cristales donde la unión entre moléculas entre sí es más favorable que con las moléculas de agua. [10] El pH es una de las manipulaciones más poderosas que se pueden asignar para la condición de cristalización óptima.
La temperatura es otro parámetro interesante para analizar, ya que la solubilidad de las proteínas es una función de la temperatura. [15] En la cristalización de proteínas, la manipulación de la temperatura para producir cristales exitosos es una estrategia común. A diferencia del pH, la temperatura de los diferentes componentes de los experimentos de cristalografía podría afectar los resultados finales, como la temperatura de preparación del tampón, [16] la temperatura del experimento de cristalización real, etc.
Los aditivos químicos son compuestos químicos pequeños que se añaden al proceso de cristalización para aumentar el rendimiento de los cristales. [17] El papel de las moléculas pequeñas en la cristalización de proteínas no había sido bien considerado en los primeros días, ya que se pensaba que eran contaminantes en la mayoría de los casos. [17] Las moléculas más pequeñas cristalizan mejor que las macromoléculas como las proteínas, por lo tanto, el uso de aditivos químicos había sido limitado antes del estudio de McPherson. Sin embargo, este es un aspecto poderoso de los parámetros experimentales para la cristalización que es importante para que los bioquímicos y cristalógrafos investiguen y apliquen más a fondo. [17]
Existen métodos de alto rendimiento que ayudan a optimizar la gran cantidad de experimentos necesarios para explorar las diversas condiciones necesarias para el crecimiento exitoso de cristales. Existen numerosos kits comerciales disponibles para ordenar que aplican ingredientes preensamblados en sistemas que garantizan una cristalización exitosa. Al usar un kit de este tipo, un científico evita la molestia de purificar una proteína y determinar las condiciones de cristalización adecuadas. [18]
Los robots que manipulan líquidos se pueden utilizar para preparar y automatizar un gran número de experimentos de cristalización simultáneamente. Lo que de otro modo sería un proceso lento y potencialmente propenso a errores si lo llevara a cabo un humano, se puede lograr de manera eficiente y precisa con un sistema automatizado. Los sistemas de cristalización robóticos utilizan los mismos componentes descritos anteriormente, pero llevan a cabo cada paso del procedimiento rápidamente y con un gran número de réplicas. Cada experimento utiliza cantidades minúsculas de solución, y la ventaja del tamaño más pequeño es doble: los tamaños de muestra más pequeños no solo reducen el gasto de proteína purificada, sino que las cantidades más pequeñas de solución conducen a cristalizaciones más rápidas. Cada experimento es monitoreado por una cámara que detecta el crecimiento de los cristales. [12]
Las proteínas se pueden diseñar para mejorar la posibilidad de una cristalización exitosa de proteínas mediante técnicas como la reducción de entropía superficial [19] o la ingeniería en contactos cristalinos. [20] Con frecuencia, los residuos de cisteína problemáticos se pueden reemplazar por alanina para evitar la agregación mediada por disulfuro , y residuos como lisina, glutamato y glutamina se pueden cambiar a alanina para reducir la flexibilidad intrínseca de la proteína, lo que puede dificultar la cristalización.
Las estructuras macromoleculares se pueden determinar a partir de cristales de proteínas utilizando una variedad de métodos, incluyendo difracción de rayos X / cristalografía de rayos X , microscopía electrónica criogénica (CryoEM) (incluyendo cristalografía electrónica y difracción de electrones de microcristales (MicroED) ), dispersión de rayos X de ángulo pequeño y difracción de neutrones . Véase también Biología estructural .
La cristalización de proteínas también puede ser útil en la formulación de proteínas para fines farmacéuticos. [21]