La adición de benzoína es una reacción de adición en la que intervienen dos aldehídos . La reacción generalmente ocurre entre aldehídos o glioxales aromáticos , [1] [2] y da como resultado la formación de una aciloína . En el ejemplo clásico, el benzaldehído se convierte en benjuí . [3]
La condensación de benjuí fue descrita por primera vez en 1832 por Justus von Liebig y Friedrich Wöhler durante sus investigaciones sobre el aceite de almendras amargas . [4] La versión catalítica de la reacción con cianuro fue desarrollada por Nikolay Zinin a finales de la década de 1830. [5] [6]
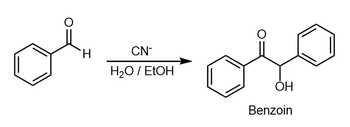
La reacción es catalizada por nucleófilos como un cianuro o un carbeno N-heterocíclico (normalmente sales de tiazolio ). El mecanismo de reacción fue propuesto en 1903 por AJ Lapworth . [7] En el primer paso de esta reacción, el anión cianuro (como cianuro de sodio ) reacciona con el aldehído en una adición nucleofílica . La reordenación del intermedio da como resultado la inversión de polaridad del grupo carbonilo , que luego se suma al segundo grupo carbonilo en una segunda adición nucleofílica. La transferencia de protones y la eliminación del ion cianuro producen benzoína como producto. Esta es una reacción reversible , lo que significa que la distribución de productos está determinada por la estabilidad termodinámica relativa de los productos y el material de partida.
En esta reacción, un aldehído dona un protón y un aldehído acepta un protón. Algunos aldehídos solo pueden donar protones, como el 4-dimetilaminobenzaldehído , mientras que el benzaldehído es a la vez aceptor y donante de protones. De esta manera es posible sintetizar benzoínas mixtas, es decir, productos con diferentes grupos en cada mitad del producto. Sin embargo, se debe tener cuidado de hacer coincidir un aldehído donador de protones con un aldehído aceptador de protones para evitar una homodimerización no deseada.
La reacción se puede extender a aldehídos alifáticos con catálisis básica en presencia de sales de tiazolio ; el mecanismo de reacción es esencialmente el mismo. Estos compuestos son importantes en la síntesis de compuestos heterocíclicos . La adición análoga en 1,4 de un aldehído a una enona se llama reacción de Stetter .
En bioquímica , la coenzima tiamina es responsable de la biosíntesis de compuestos similares a la aciloína utilizando la adición de benzoína. Esta coenzima también contiene una fracción de tiazolio, que al desprotonarse se convierte en un carbeno nucleofílico.
La versión asimétrica de esta reacción se ha realizado utilizando sales quirales de tiazolio y triazolio . Se encontró que las sales de triazolio daban un mayor exceso enantiomérico que las sales de tiazolio. [8] A continuación se muestra un ejemplo. [9]

Dado que los productos de la reacción están controlados termodinámicamente, la adición de retrobenzoína puede ser útil desde el punto de vista sintético. Si la benzoína o la aciloína se pueden sintetizar mediante otro método, entonces se pueden convertir en cetonas componentes utilizando catalizadores de cianuro o tiazolio. El mecanismo de reacción es el mismo que el anterior, pero ocurre en dirección inversa. Esto puede permitir el acceso de cetonas que de otro modo serían difíciles de producir.
![]() Medios relacionados con la animación del mecanismo de reacción de condensación del benjuí en Wikimedia Commons
Medios relacionados con la animación del mecanismo de reacción de condensación del benjuí en Wikimedia Commons