El cloruro de hierro (III) describe los compuestos inorgánicos con la fórmula FeCl3 (H2O ) x . También llamado cloruro férrico , estos compuestos son algunos de los compuestos de hierro más importantes y comunes. Están disponibles tanto en forma anhidra como hidratada, que son ambas higroscópicas . Presentan hierro en su estado de oxidación +3 . El derivado anhidro es un ácido de Lewis , mientras que todas las formas son agentes oxidantes suaves. Se utiliza como limpiador de agua y como decapante de metales.

Todas las formas de cloruro férrico son paramagnéticas , debido a la presencia de electrones desapareados que residen en orbitales 3d. Aunque el cloruro de Fe(III) puede ser octaédrico o tetraédrico (o ambos, consulte la sección de estructura), todas estas formas tienen cinco electrones desapareados, uno por orbital d . La configuración electrónica de alto espín d 5 requiere que las transiciones electrónicas dd sean de espín prohibido , además de violar la regla de Laporte . Esta doble prohibición da como resultado que sus soluciones sean solo de color pálido. O, dicho de manera más técnica, las transiciones ópticas no son intensas. El sulfato férrico acuoso y el nitrato férrico , que contienen [Fe(H 2 O) 6 ] 3+ , son casi incoloros, mientras que las soluciones de cloruro son amarillas. Por lo tanto, los ligandos de cloruro influyen significativamente en las propiedades ópticas del centro de hierro. [8] [9]
El cloruro de hierro (III) puede existir como material anhidro y como una serie de hidratos, lo que da lugar a estructuras distintas.
El compuesto anhidro es un sólido cristalino higroscópico con un punto de fusión de 307,6 °C. El color depende del ángulo de observación: con luz reflejada, los cristales aparecen de color verde oscuro, pero con luz transmitida , aparecen de color rojo púrpura. El cloruro de hierro(III) anhidro tiene la estructura BiI 3 , con centros octaédricos de Fe(III) interconectados por ligandos de cloruro de dos coordenadas . [7] [10]
El cloruro de hierro (III) tiene un punto de fusión relativamente bajo y hierve a alrededor de 315 °C. El vapor consiste en el dímero Fe 2 Cl 6 , muy parecido al cloruro de aluminio . Este dímero se disocia en el monomérico FeCl 3 (con simetría molecular de grupo puntual D 3h ) a temperaturas más altas, en competencia con su descomposición reversible para dar cloruro de hierro (II) y gas cloro . [11]
El cloruro férrico forma hidratos al exponerse al agua, lo que refleja su acidez de Lewis. Todos los hidratos presentan deliquescencia , lo que significa que se vuelven líquidos al absorber humedad del aire. La hidratación invariablemente da derivados de complejos acuosos con la fórmula [FeCl 2 (H 2 O) 4 ] + . Este catión puede adoptar estereoquímica trans o cis , lo que refleja la ubicación relativa de los ligandos de cloruro en el centro octaédrico Fe. Se han caracterizado cuatro hidratos por cristalografía de rayos X : el dihidrato FeCl 3 ·2H 2 O , el disesquihidrato FeCl 3 ·2.5H 2 O , el trisesquihidrato FeCl 3 ·3.5H 2 O y, finalmente, el hexahidrato FeCl 3 ·6H 2 O . Estas especies difieren con respecto a la estereoquímica del catión de hierro octaédrico, la identidad de los aniones y la presencia o ausencia de agua de cristalización . [9] Las fórmulas estructurales son [ trans −FeCl 2 (H 2 O) 4 ][FeCl 4 ] , [ cis −FeCl 2 (H 2 O) 4 ][FeCl 4 ]·H 2 O , [ cis −FeCl 2 (H 2 O) 4 ][FeCl 4 ]·H 2 O y [ trans −FeCl 2 (H 2 O) 4 ]Cl·2H 2 O . Los primeros tres miembros de esta serie tienen el anión tetraédrico tetracloroferrato ( [FeCl 4 ] − ). [12]
_chloride_2.JPG/440px-Iron(III)_chloride_2.JPG)
Al igual que los hidratos sólidos, las soluciones acuosas de cloruro férrico también consisten en el octaédrico [FeCl 2 (H 2 O) 4 ] + de estereoquímica no especificada. [9] La especiación detallada de soluciones acuosas de cloruro férrico es un desafío porque los componentes individuales no tienen firmas espectroscópicas distintivas. Los complejos de hierro (III), con una configuración de espín alto d 5 , son cinéticamente lábiles, lo que significa que los ligandos se disocian y reasocian rápidamente. Una complicación adicional es que estas soluciones son fuertemente ácidas, como se espera para los complejos acuosos de un metal tricatiónico. Los complejos acuosos de hierro son propensos a la olación , la formación de derivados oxo poliméricos . Las soluciones diluidas de cloruro férrico producen nanopartículas solubles con un peso molecular de 10 4 , que exhiben la propiedad de "envejecer", es decir, la estructura cambia o evoluciona con el transcurso de los días. [13] Las especies poliméricas formadas por la hidrólisis de cloruros férricos son clave para el uso de cloruro férrico para el tratamiento del agua.
En contraste con el comportamiento complicado de sus soluciones acuosas, las soluciones de cloruro de hierro (III) en éter dietílico y tetrahidrofurano se comportan bien. Ambos éteres forman aductos 1:2 de fórmula general FeCl 3 (éter) 2 . En estos complejos, el hierro es pentacoordinado. [14]
Anualmente se producen varios cientos de toneladas de cloruro de hierro(III) anhidro. El método principal, llamado cloración directa , utiliza chatarra de hierro como precursor: [10]
La reacción se lleva a cabo a varios cientos de grados, de modo que el producto es gaseoso. El uso de un exceso de cloro garantiza que el cloruro ferroso intermedio se convierta al estado férrico. [10] También se ha descrito un proceso similar, pero a escala de laboratorio. [15] [16]
También se producen industrialmente soluciones acuosas de cloruro de hierro (III) a partir de varios precursores del hierro, incluidos los óxidos de hierro:
En ruta complementaria, el metal hierro puede oxidarse con ácido clorhídrico seguido de cloración: [10]
A estos procesos se aplican varias variables, entre ellas la oxidación del hierro por cloruro férrico y la hidratación de los intermediarios. [10] Los hidratos de cloruro de hierro(III) no producen fácilmente cloruro férrico anhidro. Los intentos de deshidratación térmica producen ácido clorhídrico y oxicloruro de hierro . En el laboratorio, el cloruro de hierro(III) hidratado se puede convertir a la forma anhidra mediante el tratamiento con cloruro de tionilo [17] o cloruro de trimetilsililo : [18]
Al tener una configuración electrónica de espín d 5 alto, los cloruros de hierro (III) son lábiles , lo que significa que sus ligandos Cl y H 2 O se intercambian rápidamente con cloruro libre y agua. [9] [19] En contraste con su labilidad cinética, los cloruros de hierro (III) son termodinámicamente robustos, como lo reflejan los métodos vigorosos aplicados a su síntesis, como se describió anteriormente.
Aparte de la labilidad, que se aplica a las formas anhidras e hidratadas, la reactividad del cloruro férrico anhidro revela dos tendencias: es un ácido de Lewis y un agente oxidante . [20]
Las reacciones del cloruro de hierro (III) anhidro reflejan su descripción como oxófilo y como un ácido de Lewis duro . Existen innumerables manifestaciones de la oxofilia del cloruro de hierro (III). Cuando se calienta con óxido de hierro (III) a 350 °C, reacciona para dar oxicloruro de hierro : [21]
Los alcóxidos de metales alcalinos reaccionan para formar complejos de alcóxido de hierro (III) . Estos productos tienen estructuras más complicadas que el cloruro de hierro (III) anhidro. [22] [23] En la fase sólida se han descrito diversos complejos multinucleares para la reacción estequiométrica nominal entre FeCl 3 y etóxido de sodio :
El cloruro de hierro (III) forma un aducto 1:2 con bases de Lewis como el óxido de trifenilfosfina , por ejemplo, FeCl 3 (OP(C 6 H 5 ) 3 ) 2 . El complejo 1:2 relacionado FeCl 3 (OEt 2 ) 2 , donde Et = C 2 H 5 ) , se ha cristalizado a partir de una solución de éter. [14]
El cloruro de hierro (III) también reacciona con el cloruro de tetraetilamonio para dar la sal amarilla del ion tetracloroferrato ( (Et 4 N)[FeCl 4 ] ). De manera similar, la combinación de FeCl 3 con NaCl y KCl da Na[FeCl 4 ] y K[FeCl 4 ] , respectivamente. [24]
Además de estas reacciones estequiométricas simples , la acidez de Lewis del cloruro férrico permite su uso en una variedad de reacciones catalizadas por ácido , como se describe a continuación en la sección sobre química orgánica. [10]
En términos de su acción oxidante, el cloruro de hierro (III) oxida el polvo de hierro para formar cloruro de hierro (II) a través de una reacción de proporción : [10]
Una síntesis tradicional de cloruro ferroso anhidro es la reducción de FeCl3 con clorobenceno : [25 ]
El cloruro de hierro (III) libera gas cloro cuando se calienta por encima de 160 °C, generando cloruro ferroso : [16]
Para suprimir esta reacción, la preparación de cloruro de hierro (III) requiere un exceso de agente clorante, como se explicó anteriormente. [16] [10]
A diferencia del material anhidro, el cloruro férrico hidratado no es un ácido de Lewis particularmente fuerte ya que los ligandos de agua han apagado la acidez de Lewis al unirse a Fe(III).
Al igual que el material anhidro, el cloruro férrico hidratado es oxofílico. Por ejemplo, las sales de oxalato reaccionan rápidamente con cloruro de hierro(III) acuoso para dar [Fe( C2O4 ) 3 ] 3− , conocido como ferrioxalato . Otras fuentes de carboxilato , por ejemplo, citrato y tartrato , también se unen para dar complejos de carboxilato . La afinidad del hierro(III) por los ligandos de oxígeno fue la base de las pruebas cualitativas para fenoles. Aunque reemplazada por los métodos espectroscópicos, la prueba de cloruro férrico es una prueba colorimétrica tradicional. [26] La afinidad del hierro(III) por los fenoles se explota en la prueba de la mancha de Trinder . [27]
El cloruro de hierro (III) acuoso actúa como un oxidante de un electrón, como lo ilustra su reacción con cloruro de cobre (I) para dar cloruro de cobre (II) y cloruro de hierro (II).
Esta reacción fundamental es relevante para el uso de soluciones de cloruro férrico en el grabado del cobre.
La interacción del cloruro de hierro(III) anhidro con compuestos de organolitio y organomagnesio se ha examinado a menudo. Estos estudios son posibles debido a la solubilidad de FeCl 3 en disolventes etéreos, lo que evita la posibilidad de hidrólisis de los agentes alquilantes nucleofílicos . Dichos estudios pueden ser relevantes para el mecanismo de las reacciones de acoplamiento cruzado catalizadas por FeCl 3 . [28] El aislamiento de intermediarios de organohierro(III) requiere reacciones a baja temperatura, para que los intermediarios [FeR 4 ] − no se degraden. Utilizando bromuro de metilmagnesio como agente de alquilación, se han aislado sales de Fe(CH 3 ) 4 ] − . [29] Para ilustrar la sensibilidad de estas reacciones, el metil litio LiCH 3 reacciona con cloruro de hierro(III) para dar tetracloroferrato de litio (II) Li 2 [FeCl 4 ] : [30]
En gran medida, el acetilacetonato de hierro (III) y los complejos beta-dicetonato relacionados se utilizan más ampliamente que el FeCl3 como fuentes solubles en éter de iones férricos. [20] Estos complejos dicetonato tienen la ventaja de que no forman hidratos, a diferencia del cloruro de hierro (III), y son más solubles en solventes relevantes. [28] El bromuro de ciclopentadienilmagnesio experimenta una reacción compleja con el cloruro de hierro (III), lo que da como resultado ferroceno : [31]
Esta conversión, aunque no tuvo valor práctico, fue importante en la historia de la química organometálica, donde el ferroceno es emblemático del campo. [32]
Las aplicaciones más importantes del cloruro de hierro (III) son el tratamiento de aguas residuales y la producción de agua potable . Al formar redes altamente dispersas de materiales que contienen Fe-O-Fe, los cloruros férricos sirven como coagulantes y floculantes. [33] En esta aplicación, una solución acuosa de FeCl 3 se trata con una base para formar un flóculo de hidróxido de hierro (III) ( Fe(OH) 3 ), también formulado como FeO(OH) ( ferrihidrita ). Este flóculo facilita la separación de materiales suspendidos, clarificando el agua. [10]
El cloruro de hierro (III) también se utiliza para eliminar el fosfato soluble de las aguas residuales. El fosfato de hierro (III) es insoluble y, por lo tanto, precipita como un sólido. [34] Una posible ventaja de su uso en el tratamiento del agua es que el ion férrico oxida (desodoriza) el sulfuro de hidrógeno . [35]
También se utiliza como agente de lixiviación en la hidrometalurgia del cloruro, [36] por ejemplo en la producción de Si a partir de FeSi (proceso Silgrain de Elkem ). [37]
En otra aplicación comercial, una solución de cloruro de hierro (III) es útil para grabar cobre de acuerdo con la siguiente ecuación:
El cloruro de cobre (II) soluble se elimina por enjuague y deja un patrón de cobre. Esta química se utiliza en la producción de placas de circuito impreso (PCB). [19]
El cloruro de hierro (III) se utiliza en muchos otros pasatiempos que involucran objetos metálicos. [38] [39] [40] [41] [42]

En la industria, el cloruro de hierro (III) se utiliza como catalizador para la reacción del etileno con cloro , formando dicloruro de etileno ( 1,2-dicloroetano ): [43]
El dicloruro de etileno es un producto químico básico que se utiliza principalmente para la producción industrial de cloruro de vinilo , el monómero para fabricar PVC . [44]
Para ilustrar su uso como ácido de Lewis , el cloruro de hierro (III) cataliza la sustitución aromática electrofílica y las cloraciones . En este papel, su función es similar a la del cloruro de aluminio . En algunos casos, se utilizan mezclas de los dos. [45]
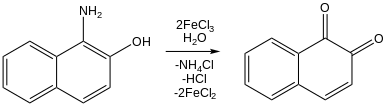
Aunque los cloruros de hierro (III) rara vez se utilizan en la síntesis orgánica práctica , han recibido considerable atención como reactivos porque son económicos, abundantes en la tierra y relativamente no tóxicos. Muchos experimentos investigan tanto su actividad redox como su acidez de Lewis. [20] Por ejemplo, el cloruro de hierro (III) oxida naftoles a naftoquinonas: [20] [46] Los 3-alquil tiofenos se polimerizan a politiofenos tras el tratamiento con cloruro férrico. [47] Se ha demostrado que el cloruro de hierro (III) promueve la reacción de acoplamiento CC . [48]
Se han desarrollado varios reactivos basados en cloruro de hierro (III) soportado . En gel de sílice , la sal anhidra se ha aplicado a ciertas reacciones de deshidratación y reordenamiento de tipo pinacol . Un reactivo similar pero humedecido induce reacciones de hidrólisis o epimerización . [49] En alúmina , se ha demostrado que el cloruro férrico acelera las reacciones de eno . [50]
Cuando se trata previamente con hidruro de sodio , el cloruro de hierro (III) produce un agente reductor de hidruro que convierte los alquenos y cetonas en alcanos y alcoholes , respectivamente. [51]
El cloruro de hierro (III) es un componente de colorantes útiles, como la solución de Carnoy , un fijador histológico con muchas aplicaciones. También se utiliza para preparar la tinción de Verhoeff . [52]
Al igual que muchos haluros metálicos, el FeCl3 se encuentra de forma natural como un mineral traza. El mineral raro molysita suele estar asociado con volcanes y fumarolas . [53] [54]
Los aerosoles a base de FeCl3 se producen por una reacción entre el polvo rico en hierro y el ácido clorhídrico de la sal marina. Este aerosol de sal de hierro causa entre el 1 y el 5 % de la oxidación natural del metano y se cree que tiene una serie de efectos refrescantes; por lo tanto, se ha propuesto como catalizador para la eliminación del metano atmosférico . [55]
Se plantea la hipótesis de que las nubes de Venus contienen aproximadamente un 1% de FeCl3 disuelto en ácido sulfúrico . [56] [57]
Los cloruros de hierro (III) se utilizan ampliamente en el tratamiento del agua potable , [10] por lo que plantean pocos problemas como venenos, en bajas concentraciones. [ ¿ Síntesis incorrecta? ] No obstante, el cloruro de hierro (III) anhidro, así como la solución acuosa concentrada de FeCl3 , son altamente corrosivos y deben manipularse utilizando el equipo de protección adecuado. [20]