El reordenamiento de Stevens en química orgánica es una reacción orgánica que convierte las sales de amonio cuaternario y las sales de sulfonio en las aminas o sulfuros correspondientes en presencia de una base fuerte en un reordenamiento 1,2 . [1]
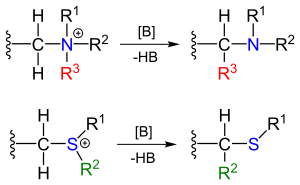
Los reactivos se pueden obtener por alquilación de las aminas y sulfuros correspondientes. El sustituyente R junto al puente de metileno de la amina es un grupo atractor de electrones .
La publicación original de 1928 de Thomas S. Stevens [2] trataba sobre la reacción de 1-fenil-2-(N,N-dimetilamino)etanona con bromuro de bencilo para obtener la sal de amonio, seguida de la reacción de reordenamiento con hidróxido de sodio en agua para obtener la amina reordenada.
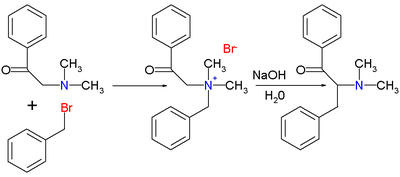
Una publicación de 1932 [3] describió la reacción del azufre correspondiente.
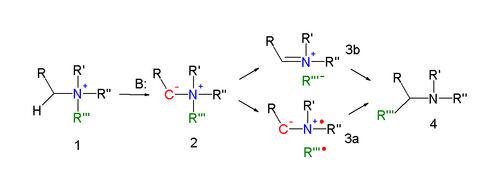
El mecanismo de reacción del reordenamiento de Stevens es uno de los más controvertidos en la química orgánica. [4] La clave del mecanismo de reacción [5] [6] del reordenamiento de Stevens (explicado para la reacción del nitrógeno) es la formación de un iluro después de la desprotonación de la sal de amonio por una base fuerte. La desprotonación se ve facilitada por las propiedades de atracción de electrones del sustituyente R. Existen varios modos de reacción para la reacción de reordenamiento real.
Una reacción concertada requiere un modo de reacción antarafacial , pero dado que el grupo migratorio muestra retención de configuración, este mecanismo es poco probable.
En un mecanismo de reacción alternativo, el enlace N–C del grupo saliente se escinde homolíticamente para formar un par dirradical ( 3a ). Para explicar la retención de configuración observada, se invoca la presencia de una jaula de disolvente . Otra posibilidad es la formación de un par catión-anión ( 3b ), también en una jaula de disolvente.
Las reacciones en competencia son el reordenamiento de Sommelet-Hauser y la eliminación de Hofmann .
En una aplicación, un reordenamiento doble de Stevens expande un anillo de ciclofano . [7] El iluro se prepara in situ mediante la reacción del compuesto diazo diazomalonato de etilo con un sulfuro catalizado por tetraacetato de dirodio en xileno a reflujo .
Recientemente, se descubrió que la γ-butirobetaína hidroxilasa , [8] [9] una enzima que participa en la vía de biosíntesis de carnitina humana, cataliza una reacción de formación de enlaces CC de una manera análoga a un reordenamiento de tipo Stevens. [8] [10] El sustrato para la reacción es el meldonio . [11]
{{cite book}}: |journal=ignorado ( ayuda )