
En química orgánica , los éteres corona son compuestos químicos cíclicos que consisten en un anillo que contiene varios grupos éter ( R−O−R' ). Los éteres corona más comunes son oligómeros cíclicos de óxido de etileno , siendo la unidad repetitiva el etilenoxi, es decir, −CH2CH2O− . Los miembros importantes de esta serie son el tetrámero ( n = 4 ), el pentámero ( n = 5) y el hexámero ( n = 6). El término "corona" se refiere a la semejanza entre la estructura de un éter corona unido a un catión y una corona colocada sobre la cabeza de una persona. El primer número en el nombre de un éter corona se refiere al número de átomos en el ciclo, y el segundo número se refiere al número de esos átomos que son oxígeno . Los éteres corona son mucho más amplios que los oligómeros de óxido de etileno; un grupo importante se deriva del catecol .
Los éteres corona se unen fuertemente a ciertos cationes, formando complejos . Los átomos de oxígeno están bien situados para coordinarse con un catión ubicado en el interior del anillo, mientras que el exterior del anillo es hidrófobo. Los cationes resultantes a menudo forman sales que son solubles en solventes no polares, y por esta razón los éteres corona son útiles en la catálisis de transferencia de fase . La denticidad del poliéter influye en la afinidad del éter corona por varios cationes. Por ejemplo, 18-corona-6 tiene alta afinidad por el catión potasio, 15-corona-5 por el catión sodio y 12-corona-4 por el catión litio. La alta afinidad de 18-corona-6 por los iones potasio contribuye a su toxicidad. El éter corona más pequeño todavía capaz de unirse a cationes es 8-corona-4, [1] siendo el éter corona más grande confirmado experimentalmente 81-corona-27. [2] Los éteres corona no son los únicos ligandos macrocíclicos que tienen afinidad por el catión potasio. Los ionóforos como la valinomicina también muestran una marcada preferencia por el catión potasio sobre otros cationes.
Se ha demostrado que los éteres corona se coordinan con los ácidos de Lewis a través de interacciones electrostáticas de σ-hueco (ver enlace halógeno ), entre los átomos de oxígeno básicos de Lewis del éter corona y el centro electrofílico del ácido de Lewis. [3] [4]
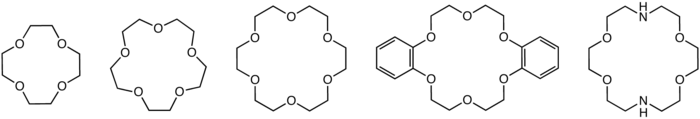
En 1967, Charles Pedersen , un químico que trabajaba en DuPont , descubrió un método simple para sintetizar un éter corona cuando intentaba preparar un agente complejante para cationes divalentes. [5] [6] Su estrategia implicaba unir dos grupos catecolato a través de un hidroxilo en cada molécula. Este enlace define un ligando polidentado que podría envolver parcialmente al catión y, por ionización de los hidroxilos fenólicos, neutralizar el dicatión unido. Se sorprendió al aislar un subproducto que complejaba fuertemente los cationes de potasio . Citando trabajos anteriores sobre la disolución de potasio en 16-corona-4, [7] [8] se dio cuenta de que los poliéteres cíclicos representaban una nueva clase de agentes complejantes que eran capaces de unir cationes de metales alcalinos . Procedió a informar estudios sistemáticos de la síntesis y las propiedades de unión de los éteres corona en una serie seminal de artículos. Los campos de la síntesis orgánica , los catalizadores de transferencia de fase y otras disciplinas emergentes se beneficiaron del descubrimiento de los éteres corona. Pedersen popularizó particularmente los éteres corona dibenzo. [9]
Pedersen compartió el Premio Nobel de Química de 1987 por el descubrimiento de las rutas sintéticas y las propiedades de unión de los éteres corona.
Debido al efecto quelato y al efecto macrocíclico , los éteres corona exhiben afinidades más fuertes para diversos cationes que sus análogos divididos o acíclicos . Por lo tanto, la selectividad de cationes para iones de metales alcalinos depende principalmente del tamaño y la densidad de carga del ion y del tamaño de la cavidad del éter corona. [10]
Las afinidades de un éter corona determinado hacia los cationes litio , sodio y potasio pueden variar en múltiples magnitudes, lo que se atribuye a las grandes diferencias en su densidad de carga. Entre los cationes potasio, rubidio y cesio, los cambios en las afinidades son menos notables, ya que su densidad de carga varía menos que la de los metales alcalinos en períodos anteriores. [10]
Aparte de su alta afinidad por los cationes potasio, el 18-corona-6 también puede unirse a aminas protonadas y formar complejos muy estables tanto en solución como en fase gaseosa. Algunos aminoácidos , como la lisina , contienen una amina primaria en sus cadenas laterales. Esos grupos amino protonados pueden unirse a la cavidad del 18-corona-6 y formar complejos estables en fase gaseosa. Se forman enlaces de hidrógeno entre los tres átomos de hidrógeno de las aminas protonadas y los tres átomos de oxígeno del 18-corona-6. Estos enlaces de hidrógeno hacen del complejo un aducto estable. Al incorporar sustituyentes luminiscentes en su estructura principal, estos compuestos han demostrado ser sondas de iones sensibles, ya que se pueden medir los cambios en la absorción o fluorescencia de los grupos fotoactivos para concentraciones muy bajas de metal presente. [14] Algunos ejemplos atractivos incluyen macrociclos, que incorporan donantes de oxígeno y/o nitrógeno, que están unidos a especies poliaromáticas como antracenos (a través de las posiciones 9 y/o 10) [15] o naftalenos (a través de las posiciones 2 y 3). [16] Algunas modificaciones de ionóforos de colorante por éteres corona exhiben coeficientes de extinción que dependen de las longitudes de cadena de los cationes encadenados. [17]