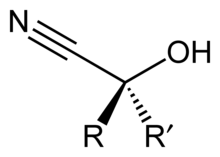
En química orgánica , una cianhidrina o hidroxinitrilo es un grupo funcional que se encuentra en compuestos orgánicos en los que un grupo ciano y un grupo hidroxi están unidos al mismo átomo de carbono. La fórmula general es R 2 C (OH) CN , donde R es H, alquilo o arilo . Las cianhidrinas son precursores industrialmente importantes de los ácidos carboxílicos y de algunos aminoácidos . Las cianhidrinas se pueden formar mediante la reacción de cianhidrina , que implica tratar una cetona o un aldehído con cianuro de hidrógeno (HCN) en presencia de cantidades excesivas de cianuro de sodio (NaCN) como catalizador: [1]
En esta reacción, el ion CN- nucleofílico ataca el carbono carbonilo electrófilo en la cetona, seguido de la protonación por HCN, regenerando así el anión cianuro . Las cianhidrinas también se preparan mediante el desplazamiento del sulfito por sales de cianuro: [2]
Las cianhidrinas son intermediarios en la síntesis de aminoácidos de Strecker . En ácido acuoso, se hidrolizan al α-hidroxiácido .
Cianhidrina de acetona , (CH 3 ) 2 C (OH) CN es la cianhidrina de la acetona . Se genera como intermediario en la producción industrial de metacrilato de metilo . [3] En el laboratorio, este líquido sirve como fuente de HCN, que es inconvenientemente volátil. [4] Por tanto, la acetonacianhidrina se puede utilizar para la preparación de otras cianhidrinas, para la transformación de HCN en aceptores de Michael y para la formilación de arenos . El tratamiento de esta cianhidrina con hidruro de litio produce cianuro de litio anhidro :
Las cianhidrinas se prepararon primero mediante la adición de HCN y un catalizador (base o enzima) al carbonilo correspondiente. [5] A escala de laboratorio, el uso de HCN (tóxico) no se recomienda en gran medida, por esta razón se buscan otros reactivos de cianación menos peligrosos. La formación in situ de HCN se puede lograr utilizando precursores como la acetonacianhidrina. Alternativamente, los derivados de cianosililo como TMS-CN permiten tanto la cianación como la protección en un solo paso sin necesidad de HCN. [6] Se han informado procedimientos similares que dependen de la formación de ésteres, fosfatos y carbonatos. [7] [8] [9]

El mandelonitrilo , de fórmula C 6 H 5 CH (OH) CN, se encuentra en pequeñas cantidades en las semillas de algunas frutas. [2] Se conocen glucósidos cianogénicos relacionados, como la amígdala . [1]

El glicolonitrilo , también llamado hidroxiacetonitrilo o cianohidrina de formaldehído, es el compuesto orgánico de fórmula HOCH 2 CN. Es la cianhidrina más simple, derivada del formaldehído . [10]