El ciclo ozono- oxígeno es el proceso mediante el cual el ozono se regenera continuamente en la estratosfera de la Tierra , convirtiendo la radiación ultravioleta (UV) en calor . En 1930, Sydney Chapman resolvió la química implicada. Los científicos atmosféricos suelen llamar al proceso ciclo Chapman .
La mayor parte de la producción de ozono se produce en la estratosfera superior y la mesosfera tropicales. La masa total de ozono producida por día en todo el planeta es de aproximadamente 400 millones de toneladas métricas. La masa global de ozono es relativamente constante en aproximadamente 3 mil millones de toneladas métricas, lo que significa que el Sol produce aproximadamente el 12% de la capa de ozono cada día. [1]
El ciclo de Chapman describe las principales reacciones que determinan de forma natural, en una primera aproximación, la concentración de ozono en la estratosfera. Incluye cuatro procesos -y un quinto, menos importante-, todos ellos relacionados con átomos y moléculas de oxígeno y radiación ultravioleta: [2]
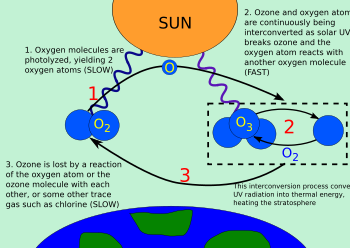
Una molécula de oxígeno se divide ( fotoliza ) por la luz ultravioleta de mayor frecuencia (extremo superior de UV-B , UV-C y superiores) en dos átomos de oxígeno (ver figura):
Cada átomo de oxígeno puede entonces combinarse con una molécula de oxígeno para formar una molécula de ozono:
Las moléculas de ozono formadas por la reacción (arriba) absorben la radiación con una longitud de onda adecuada entre UV-C y UV-B . La molécula de ozono triatómica se convierte en oxígeno molecular diatómico, más un átomo de oxígeno libre (ver figura):
El oxígeno atómico producido puede reaccionar con otra molécula de oxígeno para reformar ozono a través de la reacción de creación de ozono (reacción 2 anterior).
Estas dos reacciones forman el ciclo ozono-oxígeno, en el que la energía química liberada por la creación de ozono se convierte en energía cinética molecular. El resultado neto del ciclo es la conversión de la luz ultravioleta B penetrante en calor, sin ninguna pérdida neta de ozono. Al tiempo que mantiene la capa de ozono en equilibrio estable y protege la atmósfera inferior de la radiación ultravioleta dañina, el ciclo también proporciona una de las dos principales fuentes de calor en la estratosfera (la otra es la energía cinética, liberada cuando el O 2 se fotoliza en átomos de O individuales).
Si un átomo de oxígeno y una molécula de ozono se encuentran, se recombinan para formar dos moléculas de oxígeno:
Dos átomos de oxígeno pueden reaccionar para formar una molécula de oxígeno:
Cabe señalar que la reacción 5 es la de menor importancia en la estratosfera, ya que, en condiciones normales, la concentración de átomos de oxígeno es mucho menor que la de moléculas de oxígeno diatómico. Por lo tanto, esta reacción es menos frecuente que la creación de ozono (reacción 2).
La cantidad total de ozono en la estratosfera está determinada por el equilibrio entre la producción a partir de la radiación solar y su eliminación. La tasa de eliminación es lenta, ya que la concentración de átomos de O libres es muy baja.
Además de estas cinco reacciones, ciertos radicales libres (los más importantes son el hidroxilo (OH), el óxido nítrico (NO) y el cloro atómico (Cl) y el bromo (Br)) catalizan la reacción de recombinación , dando lugar a una capa de ozono más delgada de lo que sería si los catalizadores no estuvieran presentes.
La mayor parte de OH y NO están presentes de forma natural en la estratosfera, pero la actividad humana (especialmente las emisiones de clorofluorocarbonos ( CFC ) y halones ) ha aumentado considerablemente la concentración de Cl y Br, lo que ha provocado el agotamiento del ozono . Cada átomo de Cl o Br puede catalizar decenas de miles de reacciones de descomposición antes de ser eliminado de la estratosfera.
Para concentraciones relativas dadas de reactantes, las tasas de creación de ozono y recombinación de oxígeno (reacciones 2 y 5) son proporcionales a la densidad del aire al cubo, mientras que la tasa de conversión de ozono (reacción 4) es proporcional a la densidad del aire al cuadrado, y las reacciones de fotodisociación (reacciones 1 y 3) tienen una dependencia lineal de la densidad del aire. Por lo tanto, en la termosfera superior, donde la densidad del aire es muy baja y el flujo de fotones es alto, la fotodisociación de oxígeno es rápida mientras que la creación de ozono es baja, por lo que su concentración es baja. Por lo tanto, las reacciones más importantes son la fotodisociación de oxígeno y la recombinación de oxígeno, con la mayoría de las moléculas de oxígeno disociadas en átomos de oxígeno. [3]
A medida que nos acercamos a la termosfera inferior (por ejemplo, a 100 km de altura o menos), el flujo de fotones en las longitudes de onda <170 nm cae bruscamente debido a la absorción por el oxígeno en la reacción de fotodisociación del oxígeno (reacción 1). Este régimen de longitud de onda tiene la sección transversal más alta para esta reacción (10 -17 cm 2 por molécula de oxígeno), y por lo tanto la tasa de fotodisociación de oxígeno por molécula de oxígeno disminuye significativamente a estas altitudes, de más de 10 -7 por segundo (aproximadamente una vez al mes) a 100 km a 10 -8 por segundo (aproximadamente una vez cada pocos años) a 80 km. [4] Como resultado, la concentración de oxígeno atómico (tanto relativa como absoluta) disminuye bruscamente y la creación de ozono (reacción 2) continúa, lo que lleva a una presencia de ozono pequeña pero no despreciable. [5]
Tenga en cuenta que las temperaturas también bajan a medida que disminuye la altitud, porque las tasas de fotodisociación de fotones más bajas significan una menor producción de calor por molécula de aire.
Las especies de oxígeno impares (oxígeno atómico y ozono) tienen una tasa neta de creación solo por disociación de oxígeno (reacción 1) y una destrucción neta por conversión de ozono o recombinación de oxígeno (reacciones 4 y 5). En estado estacionario, estos procesos están equilibrados, por lo que las tasas de estas reacciones obedecen a:
En estado estable, la creación de ozono también se equilibra con su eliminación, por lo que:
De ello se deduce que:
El lado derecho es la tasa total de fotodisociación, ya sea de oxígeno o de ozono.
Por debajo de la termosfera, la concentración de oxígeno atómico es muy baja en comparación con el oxígeno molecular. [6] Por lo tanto, es mucho más probable que los átomos de oxígeno choquen con moléculas de oxígeno (diatómicas) que con otros átomos de oxígeno, lo que hace que la recombinación de oxígeno (reacción 5) sea mucho más rara que la creación de ozono (reacción 2). Siguiendo la relación de estado estacionario entre las velocidades de reacción, podemos aproximarnos a: [7]
En la mesosfera, la fotodisociación del oxígeno domina sobre la fotodisociación del ozono, por lo que tenemos aproximadamente: [4]
Por lo tanto, el ozono se elimina principalmente por conversión de ozono. Tanto la creación como la conversión de ozono dependen linealmente de la concentración de átomos de oxígeno, pero en la creación de ozono un átomo de oxígeno debe encontrarse con una molécula de oxígeno y otra molécula de aire (normalmente nitrógeno) simultáneamente, mientras que en la conversión de ozono un átomo de oxígeno solo debe encontrarse con una molécula de ozono. Por lo tanto, cuando ambas reacciones están equilibradas, la relación entre las concentraciones de ozono y oxígeno molecular es aproximadamente proporcional a la densidad del aire.
Por lo tanto, la concentración relativa de ozono es mayor a menor altitud, donde la densidad del aire es mayor. Esta tendencia continúa hasta cierto punto en la estratosfera y, por lo tanto, a medida que pasamos de 60 km a 30 km de altitud, tanto la densidad del aire como la concentración relativa de ozono aumentan aproximadamente entre 40 y 50 veces. [8] [9] [10]
La absorción por oxígeno en la mesosfera y la termosfera (en la reacción de fotodisociación de oxígeno) reduce el flujo de fotones en longitudes de onda por debajo de los 200 nanómetros, donde la fotodisociación de oxígeno está dominada por las bandas de Schumann-Runge y el continuo , con una sección transversal de hasta 10 -17 cm 2 . Debido a esta absorción, el flujo de fotones en estas longitudes de onda es tan bajo en la estratosfera, que la fotodisociación de oxígeno pasa a estar dominada por la banda de Hertzberg de la longitud de onda de fotones de 200-240 nm, aunque la sección transversal de este proceso es tan baja como 10 -24 - 10 -23 cm 2 . La tasa de fotodisociación de ozono por molécula de ozono tiene una sección transversal 6 órdenes de magnitud mayor en el rango de longitud de onda de 220-300 nm. Con concentraciones de ozono del orden de 10 -6 -10 -5 en relación con el oxígeno molecular, la fotodisociación del ozono se convierte en la reacción de fotodisociación dominante, y la mayor parte del calor de la estratosfera se genera a través de este proceso, con la mayor tasa de generación de calor por molécula en el límite superior de la estratosfera ( estratopausa ), donde la concentración de ozono ya es relativamente alta, mientras que el flujo UV sigue siendo alto también en esas longitudes de onda, antes de agotarse por este mismo proceso de fotodisociación.
Además de que la fotodisociación del ozono se convierte en una reacción de eliminación más dominante, la destrucción catalítica del ozono debido a los radicales libres (principalmente hidrógeno atómico , hidroxilo , óxido nítrico , cloro y bromuro ) aumenta la tasa efectiva de reacción de conversión del ozono. Ambos procesos actúan para aumentar la eliminación del ozono, lo que conduce a un aumento más moderado de la concentración relativa de ozono a medida que disminuye la altitud, incluso aunque la densidad del aire continúe aumentando. [4]
Debido a que tanto el ozono como el oxígeno aumentan su densidad a medida que descendemos a altitudes más bajas, el flujo de fotones UV en longitudes de onda inferiores a 300 nm disminuye sustancialmente y las tasas de fotodisociación del oxígeno caen por debajo de 10 -9 por segundo por molécula a 30 km. [4] Con la disminución de las tasas de fotodisociación del oxígeno, las especies de oxígeno impar (oxígeno atómico y moléculas de ozono) apenas se forman de novo (en lugar de transmutarse entre sí mediante las otras reacciones), y la mayor parte del oxígeno atómico necesario para la creación de ozono se deriva casi exclusivamente de la eliminación de ozono por fotodisociación de ozono. Por lo tanto, el ozono se agota a medida que descendemos por debajo de los 30 km de altitud y alcanza concentraciones muy bajas en la tropopausa . [8]
En la troposfera, la formación y destrucción del ozono ya no están controladas por el ciclo ozono-oxígeno, sino que la química del ozono troposférico está dominada hoy por contaminantes industriales y otros gases de origen volcánico. [4]