La condensación de aciloína es un acoplamiento reductor de dos ésteres carboxílicos que utilizan sodio metálico impuro para producir una α-hidroxicetona, también conocida como aciloína . [1] [2] [3]

La reacción es más exitosa cuando R es alifático y saturado , y generalmente se realiza con un reactivo de cloruro de sililo para atrapar el producto como un éter disilil enediol .
La reacción se realiza en disolventes apróticos con un alto punto de ebullición , como benceno y tolueno , en una atmósfera libre de oxígeno (ya que incluso trazas de oxígeno interfieren con la ruta de reacción y reducen el rendimiento). Los disolventes próticos efectúan la reducción del éster de Bouveault-Blanc en lugar de la condensación.
Independientemente de la dilución , la condensación de aciloína de un diéster favorece la ciclación intramolecular (para todos los anillos excepto los más pequeños) sobre la polimerización intermolecular . Se cree que este efecto se origina en una débil adsorción de los terminales éster en sitios cercanos del sodio metálico.
La condensación intramolecular de aciloína es un enfoque clásico para la síntesis de anillos alifáticos y "una de las mejores formas de cerrar anillos de 10 miembros o más". [4] Los anillos de 3 miembros no son accesibles a través de la condensación de aciloína, se forman anillos de 5 y 6 miembros con alto rendimiento (80 – 85% de rendimiento), se forman anillos de 4, 7, 10 y 11 miembros en rendimiento moderado (50 – 60 % de rendimiento), [5] se forman anillos de 8 y 9 miembros con un rendimiento pobre a modesto (30 – 40 % de rendimiento) y, finalmente, se forman anillos de 12 miembros y más con rendimientos buenos a excelentes ( >70% de rendimiento). [6] Para anillos más grandes, la insaturación no inhibe la ciclación. [4] Aunque los rendimientos para anillos de 4 miembros y de tamaño mediano son pobres a moderados, la condensación de aciloína constituye una de las primeras reacciones prácticas de ciclación para preparar estos tamaños de anillos desafiantes.
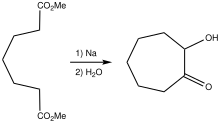
La tropolona se prepara mediante una condensación inicial de aciloína que libera 2-hidroxicicloheptanona: [7]
El éster dimetílico del ácido sebácico se puede convertir en ciclodecanodiol mediante condensación de aciloína seguida de hidrogenación utilizando un catalizador de cromito de cobre . [8]

El método Dieckmann es práctico sólo para anillos de 5 a 8 miembros (con rendimientos modestos para anillos de 7 y 8 miembros). El método Thorpe se modifica más fácilmente mediante una alta dilución (p. ej., 0,001 M en benceno/éter) para permitir la síntesis de anillos grandes, pero los anillos de 4 miembros y de 9 a 13 miembros todavía no son accesibles. La concentración es un factor mucho menos importante para obtener altos rendimientos en la condensación de aciloína, ya que la reacción se produce en la superficie del sodio metálico. [9] Aunque la necesidad de sodio metálico limita la tolerancia del grupo funcional de la reacción, en comparación con reacciones de ciclación más modernas (por ejemplo, esterificación de Yamaguchi, metátesis de olefinas con cierre de anillo), la condensación de aciloína continúa utilizándose en la síntesis de compuestos naturales complejos. Productos para la preparación de sistemas de anillos exigentes. [10]
El mecanismo consta de cuatro pasos:

La reacción también produce cantidades estequiométricas de alcóxido base, que puede catalizar la condensación competitiva de Dieckmann . [4] La técnica de Rühlmann atrapa el alcóxido y la aciloína con trimetilclorosilano para obtener rendimientos considerablemente mejores. [12] El disilil diéter puede luego disociarse con agua acidificada o metanol.

En general, el sodio muy puro produce rendimientos más bajos , ya que la reacción depende de una impureza catalítica de potasio . "La aleación de sodio y potasio es un reductor viable" . [4]
Habitualmente se emplean como disolventes tolueno , dioxano , tetrahidrofurano o dialquiléteres acíclicos . Ventajosamente también se ha utilizado N -metilmorfolina . En algunos casos, permitió una reacción exitosa, donde un producto que de otro modo sería insoluble cubrió la arena de sodio, inhibiendo la reacción .