Los complejos de aminoácidos de metales de transición son una gran familia de complejos de coordinación que contienen las bases conjugadas de los aminoácidos , los 2-aminocarboxilatos. Los aminoácidos son frecuentes en la naturaleza y todos ellos funcionan como ligandos de los metales de transición. [1] No se incluyen en este artículo los complejos de amidas (incluidos los péptidos) y los derivados de ésteres de aminoácidos. También se excluyen los poliaminoácidos, incluidos los agentes quelantes EDTA y NTA .
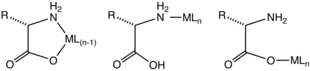
Lo más común es que los aminoácidos se coordinen con los iones metálicos como ligandos bidentados N,O, utilizando el grupo amino y el carboxilato. Son ligandos "LX". Se forma un anillo quelato de cinco miembros. El anillo quelato está ligeramente ondulado en los centros de carbono y nitrógeno hibridados sp3 .
En el caso de los aminoácidos que contienen sustituyentes coordinantes, los complejos resultantes son estructuralmente más diversos, ya que estos sustituyentes pueden coordinarse. La histidina , el ácido aspártico , la metionina y la cisteína a veces forman complejos tridentados N,N,O, N,O,O, S,N,O y S,N,O, respectivamente.
Utilizando iones metálicos cinéticamente inertes, se han caracterizado complejos que contienen aminoácidos monodentados. Estos complejos existen en isómeros de enlace N u O. Se puede suponer que dichos complejos monodentados existen transitoriamente para muchos iones metálicos cinéticamente lábiles (por ejemplo, Zn 2+ ).
La mezcla de sales metálicas simples con soluciones de aminoácidos con un pH cercano a la neutralidad o elevado a menudo produce complejos bis o tris. Para los iones metálicos que prefieren la coordinación octaédrica, estos complejos suelen adoptar la estequiometría M(aa) 3 (aa = amino carboxilato, como el glicinato, H 2 NCH 2 CO 2 − ).
Los complejos de la estequiometría 3:1 tienen la fórmula [M(O 2 CC(R)HNH 2 ) 3 ] z . Dichos complejos adoptan una geometría de coordinación octaédrica . Estos complejos pueden existir en isómeros faciales y meridionales, ambos quirales. Las posibilidades estereoquímicas aumentan cuando los ligandos de aminoácidos no son homoquirales . Se han caracterizado tanto los isómeros faciales violeta meridionales como los rojo-rosados del tris(glicinato)cobalto(III) [6] Con L- alanina , L- leucina y otros aminoácidos, se obtienen cuatro estereoisómeros. [7] Con cisteína, el aminoácido se une a través de N y tiolato. [8]
Los complejos con la estequiometría 2:1 se ilustran con el glicinato de cobre (II) [Cu(O 2 CC(R)HNH 2 ) 2 ], que existe tanto en geometrías anhidras como pentacoordinadas. Cuando el metal es plano-cuadrado, estos complejos pueden existir como isómeros cis y trans. Las posibilidades estereoquímicas aumentan cuando los ligandos de aminoácidos no son homoquirales . También se conocen complejos homolépticos en los que el carboxilato de amino es un aminoácido tridentado. Uno de estos complejos es el Ni(κ 3 -histidinato) 2 .
Además de los aminoácidos, los péptidos y las proteínas se unen a cofactores metálicos a través de sus cadenas laterales. En su mayor parte, los grupos α-amino y carboxilato no están disponibles para la unión, ya que de lo contrario estarían involucrados en el enlace peptídico. La situación es más complicada para los residuos N-terminales y O-terminales, donde los grupos α-amino y carboxilato no están disponibles, respectivamente. Especialmente importantes a este respecto son la histidina ( imidazol ), la cisteína ( tiolato ) y la metionina ( tioéter ).
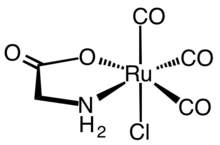
Los complejos de ligando mixto son comunes para los aminoácidos. Algunos ejemplos bien conocidos incluyen [Co(en) 2 (glicinato)] 2+ , donde en ( etilendiamina ) es un ligando espectador. En el área de complejos organometálicos, un ejemplo es Cp*Ir(κ 3 -metionina).
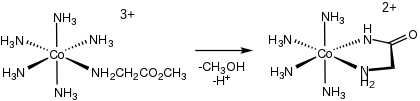
Un complejo bien estudiado es el tris(glicinato)cobalto(III) . Se produce por la reacción de la glicina con el tris(carbonato)cobalto(III) sódico . [6] Se aplican métodos sintéticos similares a la preparación de tris(quelatos) de otros aminoácidos . [10]
Comúnmente, los complejos de aminoácidos se preparan mediante reacciones de desplazamiento de ligandos de complejos metálicos acuosos y bases conjugadas de aminoácidos: [11]
En relación con la química bioinorgánica , los complejos de aminoácidos se pueden generar mediante la hidrólisis de ésteres y amidas de aminoácidos (en = etilendiamina ):
Debido a que su anillo quelato MNC 2 O de 5 miembros es bastante estable, los complejos de aminoácidos representan grupos protectores para los aminoácidos, lo que permite diversas reacciones de las cadenas laterales. [12]
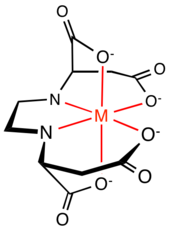
Los compuestos orgánicos que presentan dos o más grupos 2- y 3-aminocarboxilato son ligandos de amplio uso en la naturaleza, la industria y la investigación. Algunos ejemplos famosos son el EDTA y el NTA .
{{cite journal}}: CS1 maint: varios nombres: lista de autores ( enlace ){{cite journal}}: CS1 maint: multiple names: authors list (link){{cite journal}}: CS1 maint: multiple names: authors list (link)