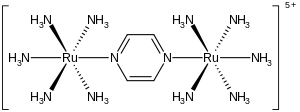
El ion Creutz-Taube es el complejo metálico con la fórmula {[ Ru ( NH3 ) 5 ] 2 ( C4H4N2 ) } 5+ . Esta especie catiónica ha sido estudiada en profundidad en un esfuerzo por comprender los detalles íntimos de la transferencia de electrones en la esfera interna , es decir, cómo se mueven los electrones de un complejo metálico a otro. El ion recibe su nombre de Carol Creutz , quien preparó por primera vez el complejo, y de su asesor de tesis Henry Taube , quien recibió un Premio Nobel de Química por este y otros descubrimientos relacionados con la transferencia de electrones. [1] [2]
El complejo consta de dos unidades de rutenio pentamina unidas a los átomos de nitrógeno en un ligando de pirazina puente , que completa la esfera de coordinación octaédrica de cada metal. La característica importante del compuesto es que los dos metales tienen estados de oxidación fraccionales aparentes de +2,5. Normalmente, los iones metálicos, como la mayoría de los iones, tienen estados de oxidación enteros. Por ejemplo, los complejos de amina de rutenio suelen ser +2 o +3. El hecho de que los estados de oxidación sean semienteros indica que los dos centros Ru(NH 3 ) 5 son equivalentes en términos de su número de electrones. Los estudios cristalográficos y teóricos son consistentes con esta descripción, es decir, los dos centros metálicos son equivalentes. [3] [4] Característico de un complejo de valencia mixta , este ion absorbe fuertemente la luz en la parte cercana al infrarrojo del espectro electromagnético . En el caso del ion Creutz–Taube, el máximo de absorción ocurre a 1570 nm . Esta absorción se describe como una banda de transferencia de carga intervalar .
El ion se aisló originalmente como sal tosilato hidratada [Ru(NH 3 ) 5 ] 2 (C 4 H 4 N 2 )(O 3 SC 6 H 4 CH 3 ) 5 ·3H 2 O. Se prepara en dos pasos a través del complejo de pirazina Ru(III)-Ru(III):. [3]
El ion Creutz-Taube ilustra las ventajas de los complejos de rutenio para examinar las reacciones redox. Los iones Ru(II) y Ru(III) pueden interconvertirse a potenciales redox moderados . Ambos estados de oxidación son cinéticamente inertes. Se han preparado muchos análogos de este ion utilizando diferentes ligandos puente.