La cadena de colágeno α-1 (XXIII) es una proteína codificada por el gen COL23A1 , que se encuentra en el cromosoma 5q35 en humanos y en el cromosoma 11B1+2 en ratones. [5] La ubicación de este gen se descubrió mediante análisis de secuencia genómica .
El colágeno XXIII es una proteína transmembrana de tipo II y la cuarta de la subfamilia de colágenos transmembranosos no fibrilares. Este tipo de colágenos tienen un dominio transmembrana hidrofóbico de un solo paso. La molécula de colágeno XXIII se puede encontrar en forma de unión a la membrana o en forma desprendida.
El colágeno tipo XXIII se expresa tanto en los tejidos adultos como en los órganos en desarrollo. Se puede encontrar en la epidermis y otros epitelios como los de la lengua, el intestino y los pulmones, pero también en el cerebro, los riñones y la córnea. Se ha demostrado que en la próstata la expresión de colágeno XXIII está asociada con la progresión tumoral.
Las funciones del colágeno XXIII son aún desconocidas, aunque se cree que podrían ser similares a otras proteínas transmembrana, como el colágeno XIII .
Jacqueline Banyard, Lere Bao y Bruce R. Zetter identificaron y aislaron por primera vez el colágeno XXIII a partir de células de carcinoma de próstata de rata en 2003. [6] También identificaron esta proteína en tejido humano. Concluyeron que, a nivel de nucleótidos, el colágeno XXIII alfa 1 humano y de rata muestra una identidad del 76 %. Además, la localización celular del colágeno XXIII se determinó mediante tinción de inmunofluorescencia , utilizando un anticuerpo que reconoce el extremo carboxilo terminal de la proteína. Se demostró que el extremo carboxilo terminal del colágeno XXIII está presente en la superficie celular.
El colágeno humano α1(XXIII), que es un homotrímero, contiene 540 aminoácidos distribuidos en:
El colágeno XXIII pertenece a la subfamilia transmembranosa de los colágenos . Las proteínas que se incluyen en este grupo presentan un dominio citoplasmático amino-terminal seguido de un dominio hidrofóbico que atraviesa la membrana y al menos un dominio colagenoso de triple hélice extracelular alternado con dominios no colagenosos cortos.
Los colágenos XIII , XVII y XXV y proteínas relacionadas como los receptores depuradores de macrófagos de clase A, la ectodisplasina A o el receptor MARCO1 también forman parte de este grupo. Un nombre alternativo para este tipo de proteínas es MACIT (colágenos asociados a membrana con triple hélice interrumpida).
El colágeno XXIII muestra homología estructural con el colágeno XIII y el colágeno XXV [7] . Además de tener la estructura característica de los colágenos transmembranosos, las tres proteínas presentan un alto nivel de conservación de residuos de aminoácidos en los dominios colagenosos y no colagenosos.
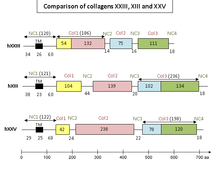
Los colágenos α1(XIII), α1(XXIII) y α1(XXV) muestran tres dominios colagenosos (Col 1, Col 2 y Col 3) y cuatro dominios no colagenosos (NC1, que también es un dominio transmembranoso, NC2, NC3 y NC4).
Se ha informado que el dominio Col 1 de α1(XXIII) muestra similitudes con regiones de los dominios Col 1 y Col 2 de los tipos de colágeno α1(XIII) y α1(XXV), mientras que las secuencias de los dominios Col 2 y Col 3 de α1(XXIII) están relacionadas con el dominio Col 3 de los tipos α1(XIII) y α1(XXV).
Los dominios cortos no colagenosos también presentan similitudes, especialmente en los dominios NC1 y NC4. Entre el 60 y el 78% de los residuos de aminoácidos de estos dominios son idénticos en las tres cadenas. Además, se han encontrado posibles secuencias de reconocimiento para los sitios de escisión de la furina (una proteasa fisiológica importante ) tanto en el dominio amino-terminal NC1 como en el dominio carboxilo-terminal NC4 de cada uno de estos colágenos. La actividad de esta proteasa es vital para explicar el origen de las dos formas que pueden adoptar los colágenos tipo XIII, XXIII y XXV.

Una característica común de los colágenos transmembrana es la presencia de dos formas de la molécula: una forma unida a la membrana de longitud completa y una forma desprendida del ectodominio . Esta característica también puede aplicarse al colágeno XXIII.
La distribución de ambas formas de colágeno XXIII es específica de cada tejido, ya que hay órganos como el cerebro donde predomina la forma desprendida, mientras que en los pulmones la molécula se encuentra generalmente en su forma completa.
Se ha descrito que la célula es capaz de regular las cantidades de colágeno XXIII en la forma unida a la membrana y en la forma secretada, influyendo en la producción de una u otra forma cuando es necesario. Por ello, el proceso de desprendimiento del colágeno XXIII se ha descrito como una proteólisis selectiva , llevada a cabo principalmente por la furina [8] , aunque existen otras enzimas, como las serina y cisteína proteasas, que también son capaces de desprender la molécula.
Cuando el colágeno XXIII se encuentra dentro del aparato de Golgi , las furina proteasas actúan escindiendo la proteína y originando la forma desprendida de la molécula, que será liberada a la matriz extracelular mediante exocitosis .
También existe la posibilidad de que la molécula en su forma completa alcance la superficie celular antes de que la furina la escinda. Cuando esto sucede, la molécula completa de colágeno se introduce en la membrana plasmática y se estabiliza mediante sus dominios transmembranosos no colagenosos, dejando los dominios colagenosos fuera de la célula.
Las moléculas de colágeno XXIII de longitud completa se encuentran generalmente en las balsas lipídicas , que son microdominios de la membrana celular muy compactos y ricos en colesterol y esfingolípidos. Las furin proteasas no pueden alcanzar las moléculas de colágeno XXIII cuando están dentro de las balsas lipídicas , por lo tanto, las moléculas de colágeno XXIII pueden conservar su forma completa.
En caso de que estas moléculas pierdan la protección de la balsa lipídica (es decir, cuando los niveles de colesterol de la membrana disminuyen), las furina proteasas pueden actuar, escindiendo la proteína justo fuera de la célula, liberando la forma desprendida del colágeno XXIII directamente a la matriz extracelular .
Los receptores celulares de colágeno pertenecen a la familia de las integrinas β1 . El colágeno XXIII interactúa de manera dependiente de iones y conformación con la integrina α2β1 . [9] La integrina α2β1 es una integrina que se une al colágeno y que se encuentra presente en la epidermis, por lo que esta es la ubicación donde tiene lugar la interacción. Ambas proteínas se localizan conjuntamente en la superficie de los queratinocitos basales .
El colágeno XXIII desempeña un papel como biomarcador para la detección y recurrencia de células NCLSC (carcinoma de pulmón de células no pequeñas) [10] y la reaparición del cáncer de próstata. [11] Algunos experimentos sugieren que el colágeno XXIII influye en la adhesión celular y estimula el desarrollo de metástasis [12] al facilitar el crecimiento y la supervivencia de las células cancerosas cuando son redondeadas y no pueden propagarse. Se ha demostrado que la pérdida de colágeno XXIII puede complicar la adhesión celular y reducir la retención de células de cáncer de pulmón.