La citocromo - b 5 reductasa es una enzima dependiente de NADH que convierte el ferricitocromo de una forma Fe3+ a una forma Fe2+. [1] Contiene FAD y cataliza la reacción:
En su capacidad de reducir la b5, esta enzima está involucrada en la desaturación y elongación de los ácidos grasos, la biosíntesis del colesterol y el metabolismo de los fármacos. Esta enzima también puede reducir la metahemoglobina a hemoglobina normal , lo que le otorga el sinónimo impreciso de metahemoglobina reductasa . Las isoformas expresadas en los eritrocitos (CYB5R1, CYB5R3) realizan esta función in vivo . El ferricianuro es otro sustrato in vitro . [ cita requerida ]
La citocromo b5 reductasa (c5br) es una enzima dependiente de NADH conocida como flavoproteína que da como resultado la reducción química a dos isoformas diferentes , una forma soluble y una forma unida a la membrana. [2] Esta enzima está involucrada en la transferencia de equivalentes reductores de NADH debido al aceptor de electrones FAD en el citocromo b5 , ubicado en el complejo III de la cadena de transporte de electrones, que da como resultado las dos isoformas debido al empalme alternativo . La reacción de reducción general de la citocromo b5 reductasa ayuda al control del hierro en los glóbulos rojos , lo que dicta la cantidad de oxígeno que transportan las células. [3]
Los citocromos son proteínas redox esenciales para la transferencia de energía en la cadena de transporte de electrones con la ayuda de una enzima como la reductasa . Los citocromos se clasifican en tres clases (a, b y c) de acuerdo con el tipo de hemo presente en el núcleo y sus espectros de absorción de luz.
La proteína especializada citocromo b5 es un citocromo de clase B con un hemo b de alto y bajo potencial unido al hierro central de la proteína. [4] La clase de citocromo b es especialmente única porque está unida a proteínas dentro de la membrana mitocondrial interna en lugar de en la porción externa, y esta clase particular tiene una alta variación de secuencia. Con la capacidad de expresar aproximadamente 1080 pares de bases , las proteínas del citocromo b se estudian comúnmente para analizar el ADN mitocondrial y determinar las relaciones filogenéticas a lo largo de la evolución. [5]
Por lo tanto, las enzimas citocromo reductasas son un componente esencial de la cadena de transporte de electrones que lleva a cabo la función de las proteínas citocromo y activa sus reacciones. La citocromo b5 reductasa cataliza con éxito la transferencia de electrones de equivalentes reductores para luego activar el citocromo b para que lleve a cabo su función en los organismos. [6]

La enzima citocromo b5 reductasa contiene una estructura típica de oxidorreductasa con un complejo de dominio de unión de diaforasa para NADH y un dominio de unión de FAD. Está presente un dominio de enlace de tres cadenas, así como enlaces de hidrógeno mediados por agua , para conectar bioquímicamente el complejo. [8] Una vez que la citocromo b5 reductasa cataliza la transferencia de electrones, la forma reducida resultante de citocromo b5 reduce el ion férrico oxidado de la hemoglobina de Fe 3+ a Fe 2+. [1]
Mecanismo: NADH + H + + 2 ferricitocromo b5 -> NAD + + 2 ferrocitocromo b5
Las características de las enzimas citocromo b5 reductasas permiten la reducción exitosa de moléculas de citocromo b5 para su uso en diversas funciones a lo largo de la cadena de transporte de electrones y el metabolismo. En el metabolismo, c5br es activo en la conversión de lípidos que implica la elongación y desaturación de ácidos grasos y la biosíntesis de colesterol. [9]
Las isoformas especializadas de la enzima c5br son muy funcionales en la sangre para ayudar a transportar oxígeno a los tejidos del cuerpo mediante la transformación conformacional de la metahemoglobina en hemoglobina . Otras isoformas son útiles en las reacciones químicas en todo el cuerpo, ya que ayudan a descomponer varias sustancias. [10]
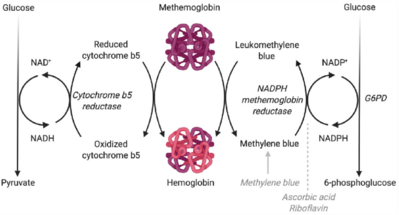
En los organismos vivos, debido a que la metahemoglobina (MetHb) no puede unirse al oxígeno, debe reducirse a hemoglobina (Hb) a través de la acción de la isoforma soluble de la citocromo b5 reductasa. En general, la mecánica de esta reacción incluye la transferencia de electrones a través de pasos de oxidación, que se pueden lograr a través de un par de mecanismos diferentes que involucran la reducción de nucleótidos de piridina . [11] Un mecanismo, que también es la vía más presente de forma natural, involucra la transferencia de electrones catalizada por la citocromo b5 reductasa a través de la oxidación de NADH a NAD+. El donador de electrones, NADH, que apoya esta reacción es un producto de la oxidación de la glucosa a partir de la glucólisis . La reacción de reducción convierte la metahemoglobina oxidada a la forma de hemoglobina reducida, que ahora tiene afinidad por el oxígeno. [12] Otro mecanismo implica la conversión del nucleótido de piridina reducida nucleótido trifosfopiridina (TPNH) a azul de metileno , que es inducido por la transferencia de electrones en la oxidación de NADPH a NADP+ por la NAPHD metahemoglobina reductasa. [11] TPNH es el nucleótido de piridina más favorable para reducir la metahemoglobina; sin embargo, se pueden utilizar otros cofactores, incluido el azul de leucometileno. [13] Las piridinas de nucleótidos reducidos adicionales también pueden catalizar la oxidación de la hemoglobina a metahemoglobina. Por ejemplo, en la reacción inversa de la NAPHD metahemoglobina reductasa, se puede utilizar azul de metileno para catalizar la oxidación de la hemoglobina a metahemoglobina. Otras enzimas, incluidas las enzimas diaforasas , pueden convertir el nucleótido de difosfopiridina reducida (DPNH) de gliceraldehído-3-fosfato para reponer los niveles de metahemoglobina en la célula. [14]
La isoforma unida a la membrana de la citocromo b5 reductasa se encuentra en todos los tipos de células y no se limita a los glóbulos rojos. Por lo general, se encuentra incrustada en las membranas de varios compartimentos celulares, con un dominio insertado en la bicapa lipídica en la hoja externa del retículo endoplasmático. [10] Esta isoforma específica está compuesta por aproximadamente 300 residuos de aminoácidos con una cola N-terminal de 24 residuos que ancla la proteína a la membrana. [6] Hay un dominio soluble posterior que es parte de esta isoforma que se adhiere al citosol. Debido a su estructura y ubicación, la isoforma unida a la membrana de c5br es esencial para las funciones biológicas dentro de los organismos. [6] Al poseer un dominio de unión a la membrana y un dominio soluble en agua, esta isoforma puede llevar a cabo reacciones químicas y redox para la cadena de transporte de electrones y es funcional en la formación de ácidos grasos , la formación de colesterol y la descomposición de moléculas y fármacos. [9]
La isoforma soluble de la citocromo b5 reductasa se encuentra presente únicamente en los glóbulos rojos. En los eritrocitos , glóbulos rojos, la enzima c5br es responsable del reciclaje y la conversión de la metahemoglobina en hemoglobina. [6] La metahemoglobina es una forma oxidada de la hemoglobina unida a un hierro en estado férrico (Fe3+), que por lo tanto no puede transportar y entregar oxígeno a los tejidos. [15] La formación de metahemoglobina ocurre cuando los electrones no se devuelven al hierro de una hemoglobina en estado normal, lo que no es preferible para un organismo funcional. La metahemoglobina no es favorable para un organismo funcional ya que el oxígeno necesita ser transferido constantemente; por lo tanto, la isoforma soluble de c5br es esencial para mantener bajos los niveles de metahemoglobina en humanos. [16]
Las mutaciones de la citocromo b5 reductasa pueden provocar muchos trastornos, incluida la metahemoglobinemia congénita autosómica recesiva. Existen más de 65 mutaciones de la enzima que pueden provocar varios tipos de este trastorno. [10] Algunas de ellas son:
La mayoría de los casos de metahemoglobinemia son tratables y no son crónicos. El tratamiento más común y exitoso utilizado para tratar a pacientes con altos niveles de metahemoglobinemia es el antídoto azul de metileno. El azul de metileno ya se reconoce como un producto de la reacción reversible impulsada por la metahemoglobina reductasa NAPHD, catalizada por leuccometileno, para reducir la metahemoglobina a hemoglobina. Por lo tanto, cuando los niveles de metahemoglobina son altos en un paciente, se puede introducir azul de metileno adicional para reducirlo a leuccometileno y catalizar ahora la reducción del exceso de metahemoglobina a hemoglobina. [23] Si bien la adición de azul de metileno para tratar casos de metahemoglobinemia ha sido probada y comprobada científicamente, existen algunos efectos secundarios que se deben tener en cuenta y controlar con altas dosis del antídoto. Los efectos secundarios menores incluyen decoloración verde o azul de la orina; sin embargo, los efectos secundarios significativos incluyen el empeoramiento de la metahemoglobinemia actual. Debido a que el azul de metileno es un agente oxidante en sí mismo, cuando no se reduce de manera efectiva, el NADPH no se restaurará adecuadamente en la célula para la transferencia de electrones, lo que da como resultado niveles aumentados de metahemoglobina no reducida para apoyar la metahemoglobinemia en los pacientes. [23] Estudios adicionales han encontrado que el uso de azul de metileno durante el embarazo está asociado con un alto riesgo de atresia del intestino delgado, que puede ser fatal para el feto. [24]
Se recomienda que el tratamiento con azul de metileno requiera dos dosis antes de que se considere ineficaz. Si los síntomas de metahemoglobinemia aún están presentes después de la segunda dosis, se pueden considerar tratamientos alternativos, incluido el ácido ascórbico , la exanguinotransfusión y la terapia con oxígeno hiperbárico . Sin embargo, no se ha probado ni confirmado ningún antídoto adicional en la medida del azul de metileno y, en la mayoría de los casos, los antídotos adicionales generalmente son ineficaces. También se observa que las dosis altas de ácido ascórbico se asocian con un aumento de la excreción urinaria de oxalato e insuficiencia renal. [23] [25]
La citocromo b5 reductasa es un tema de estudio frecuente en las investigaciones y los ensayos clínicos para comprender las funciones adicionales de la enzima en otras vías metabólicas del organismo. Los ratones y las moscas son organismos modelo habituales que se utilizan para comprobar la relación de la citocromo b5 reductasa con la salud general de los organismos vivos.
Un estudio reciente de 2023 utilizó ratones como modelo para probar los efectos extendidos de c5br sobre el suministro de oxígeno en presencia de estrés oxidativo adicional, como el de la anemia de células falciformes o el accidente cerebrovascular isquémico . Los resultados mostraron que c5br no solo aumenta el suministro y el transporte de oxígeno en un organismo de tipo salvaje, sino que también regula la respuesta de la eritropoyetina al accidente cerebrovascular isquémico. Estos hallazgos han convertido a la citocromo b5 reductasa en un objetivo para futuras investigaciones sobre el manejo del riesgo de accidente cerebrovascular y la provisión de una ventaja selectiva para aquellos con trastornos genéticos como la anemia de células falciformes. [26]
Otro estudio con ratones y moscas probó el papel fisiológico de la citocromo b5 reductasa en el metabolismo lipídico, la salud y el envejecimiento. Al activar el gen que expresa cb5r en ambos organismos modelo, se observó que la esperanza de vida y el metabolismo lipídico se vieron afectados positivamente. En las moscas modelo, se utilizó el fármaco tetrahidroindenoindol para activar la actividad de la citocromo b5 reductasa, y las observaciones concluyeron que el aumento de la función de cb5r extendió la esperanza de vida de la mosca. El aumento de la expresión de citocromo b5 reductasa en ratones resultó en altos niveles de ácidos grasos poliinsaturados de cadena larga, mejor función mitocondrial y una disminución del daño oxidativo, lo que indica vías metabólicas mejoradas con altos niveles de actividad de cb5r. Estos resultados indican que la citocromo b5 reductasa es un nuevo objetivo para nuevas investigaciones y desarrollos del metabolismo lipídico y la salud en organismos vivos. [9]