Una bicapa lipídica modelo es cualquier bicapa ensamblada in vitro , a diferencia de la bicapa de las membranas celulares naturales o que cubre varias estructuras subcelulares como el núcleo . Se utilizan para estudiar las propiedades fundamentales de las membranas biológicas en un entorno simplificado y bien controlado, y cada vez más en biología sintética ascendente para la construcción de células artificiales . [1] Se puede fabricar un modelo de bicapa con lípidos sintéticos o naturales . Los sistemas modelo más simples contienen sólo un lípido sintético puro. Se pueden fabricar modelos de bicapas más relevantes fisiológicamente con mezclas de varios lípidos sintéticos o naturales.
Hay muchos tipos diferentes de modelos de bicapas, cada uno de los cuales tiene ventajas y desventajas experimentales. El primer sistema desarrollado fue la membrana lipídica negra o bicapa “pintada”, que permite una caracterización eléctrica simple de las bicapas, pero tiene una vida corta y puede resultar difícil trabajar con él. Las bicapas soportadas están ancladas a un sustrato sólido, lo que aumenta la estabilidad y permite el uso de herramientas de caracterización que no son posibles en una solución a granel. Estas ventajas tienen el costo de interacciones de sustrato no deseadas que pueden desnaturalizar las proteínas de la membrana .
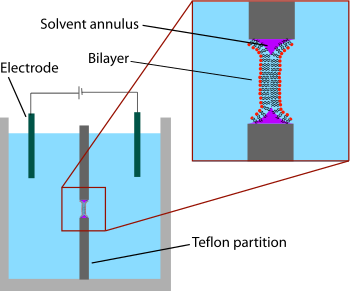
El primer modelo de sistema bicapa desarrollado fue la bicapa "pintada", también conocida como "membrana lipídica negra". El término "pintado" se refiere al proceso mediante el cual se fabrican estas bicapas. Primero, se crea una pequeña abertura en una fina capa de un material hidrófobo como el teflón . Normalmente, el diámetro de este agujero es de unas pocas decenas de micrómetros hasta cientos de micrómetros. Para formar un BLM, primero se "pinta previamente" el área alrededor de la apertura con una solución de lípidos disueltos en un disolvente hidrofóbico aplicando esta solución a través de la apertura con un cepillo, una jeringa o un aplicador de vidrio. [2] El disolvente utilizado debe tener un coeficiente de partición muy alto y debe ser relativamente viscoso para evitar la ruptura inmediata. El disolvente más común utilizado es una mezcla de decano y escualeno .
Después de dejar secar la abertura, se añade una solución salina (fase acuosa) a ambos lados de la cámara. Luego se "pinta" la abertura con una solución lipídica (generalmente la misma solución que se utilizó para el pintado previo). Se forma espontáneamente una monocapa lipídica en la interfaz entre las fases orgánica y acuosa a ambos lados de la gotita de lípido/disolvente. Debido a que las paredes de la abertura son hidrófobas, la solución de lípido/disolvente humedece esta interfaz, adelgazando la gota en el centro. Una vez que los dos lados de la gota se acercan lo suficiente, las monocapas lipídicas se fusionan, excluyendo rápidamente el pequeño volumen restante de solución. En este punto se forma una bicapa en el centro de la abertura, pero queda un anillo significativo de disolvente en el perímetro. Este anillo es necesario para mantener la estabilidad actuando como un puente entre la bicapa de ~ 5 nm y la lámina de decenas de micrómetros de espesor en la que se realiza la apertura. [3]
El término bicapa “negra” se refiere al hecho de que son oscuras ante la luz reflejada porque el grosor de la membrana es de sólo unos pocos nanómetros, por lo que la luz que se refleja en la cara posterior interfiere destructivamente con la luz que se refleja en la cara frontal. De hecho, esta fue una de las primeras pistas de que esta técnica producía una membrana de espesor a escala molecular. [4] Las membranas lipídicas negras también son adecuadas para la caracterización eléctrica porque las dos cámaras separadas por la bicapa son accesibles, lo que permite la colocación sencilla de electrodos grandes. Por esta razón, la caracterización eléctrica es uno de los métodos más importantes utilizados junto con las bicapas lipídicas pintadas. Mediciones simples indican cuándo se forma una bicapa y cuándo se rompe, ya que una bicapa intacta tiene una resistencia grande (>GΩ) y una capacitancia grande (~2 µF/cm 2 ). Una caracterización eléctrica más avanzada ha sido particularmente importante en el estudio de canales iónicos dependientes de voltaje . Las proteínas de membrana, como los canales iónicos, normalmente no se pueden incorporar directamente en la bicapa pintada durante la formación porque la inmersión en un disolvente orgánico desnaturalizaría la proteína. En cambio, la proteína se solubiliza con un detergente y se añade a la solución acuosa después de que se forma la bicapa. La capa de detergente permite que estas proteínas se inserten espontáneamente en la bicapa durante un período de minutos. Además, se han realizado experimentos iniciales que combinan investigaciones electrofisiológicas y estructurales de las membranas lipídicas negras. [5] En otra variación de la técnica BLM, denominada punzón bicapa, se utiliza una pipeta de vidrio (diámetro interior ~10-40 µm) como electrodo en un lado de la bicapa para aislar un pequeño parche de membrana. [6] [7] Esta modificación de la técnica de abrazadera de parche permite una grabación con poco ruido, incluso a potenciales altos (hasta 600 mV), a expensas de un tiempo de preparación adicional.
Los principales problemas asociados con las bicapas pintadas son el disolvente residual y la vida útil limitada. Algunos investigadores creen que las bolsas de disolvente atrapadas entre las dos valvas bicapa pueden alterar la función normal de las proteínas. Para superar esta limitación, Montal y Mueller desarrollaron una técnica de deposición modificada que elimina el uso de un disolvente pesado no volátil. En este método, la abertura comienza por encima de la superficie del agua, separando completamente las dos cámaras de fluido. En la superficie de cada cámara, se forma una monocapa aplicando lípidos en un disolvente volátil como el cloroformo y esperando a que el disolvente se evapore. Luego se baja la abertura a través de la interfaz aire-agua y las dos monocapas de las cámaras separadas se pliegan una contra la otra, formando una bicapa a lo largo de la abertura. [8] La cuestión de la estabilidad ha resultado más difícil de resolver. Normalmente, una membrana lipídica negra sobrevivirá menos de una hora, lo que excluye experimentos a largo plazo . Esta vida útil se puede prolongar estructurando con precisión la abertura de soporte, [9] reticulando químicamente los lípidos o gelificando la solución circundante para soportar mecánicamente la bicapa. [10] Se está trabajando en este ámbito y será factible una vida útil de varias horas.
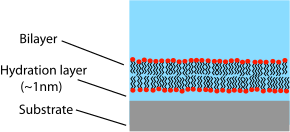
A diferencia de una vesícula o una membrana celular en la que la bicapa lipídica se enrolla formando una capa cerrada, una bicapa sostenida es una estructura plana asentada sobre un soporte sólido. Debido a esto, sólo la cara superior de la bicapa está expuesta a la solución libre. Este diseño tiene ventajas e inconvenientes relacionados con el estudio de bicapas lipídicas. Una de las mayores ventajas de la bicapa soportada es su estabilidad. Los SLB permanecerán en gran medida intactos incluso cuando estén sujetos a altos caudales o vibraciones y, a diferencia de las membranas lipídicas negras, la presencia de agujeros no destruirá toda la bicapa. Debido a esta estabilidad, son posibles experimentos que duren semanas e incluso meses con bicapas compatibles, mientras que los experimentos BLM generalmente se limitan a horas. [11] Otra ventaja de la bicapa soportada es que, debido a que está sobre una superficie plana y dura, es susceptible de una serie de herramientas de caracterización que serían imposibles o ofrecerían una resolución más baja si se realizaran en una muestra que flota libremente.
Uno de los ejemplos más claros de esta ventaja es el uso de técnicas de sondeo mecánico que requieren una interacción física directa con la muestra. La microscopía de fuerza atómica (AFM) se ha utilizado para obtener imágenes de la separación de fases lipídicas , [12] la formación de nanoporos transmembrana seguida de la adsorción de una sola molécula de proteína, [13] y el ensamblaje de proteínas [14] con una precisión inferior a nm sin necesidad de un tinte de etiquetado. . Más recientemente, el AFM también se ha utilizado para investigar directamente las propiedades mecánicas de bicapas individuales [15] y para realizar espectroscopia de fuerza en proteínas de membrana individuales. [16] Estos estudios serían difíciles o imposibles sin el uso de bicapas soportadas, ya que la superficie de una célula o vesícula es relativamente blanda y se desplazaría y fluctuaría con el tiempo. Otro ejemplo de sonda física es el uso de la microbalanza de cristal de cuarzo (QCM) para estudiar la cinética de unión en la superficie de la bicapa. [17] La interferometría de polarización dual es una herramienta óptica de alta resolución para caracterizar el orden y la alteración de las bicapas lipídicas durante las interacciones o transiciones de fase , proporcionando datos complementarios a las mediciones QCM. [18]
Muchas técnicas modernas de microscopía de fluorescencia también requieren una superficie plana con soporte rígido. Los métodos de campo evanescente , como la microscopía de fluorescencia de reflexión interna total (TIRF) y la resonancia de plasmón superficial (SPR), pueden ofrecer una medición extremadamente sensible de la unión del analito y las propiedades ópticas de la bicapa, pero solo pueden funcionar cuando la muestra está soportada sobre materiales ópticamente funcionales especializados. Otra clase de métodos aplicables sólo a bicapas soportadas son los basados en interferencia óptica, como la microscopía de contraste de interferencia de fluorescencia (FLIC) y la microscopía de contraste de interferencia de reflexión (RICM) o la microscopía de dispersión interferométrica (iSCAT). [19] [20] Cuando la bicapa se apoya sobre una superficie reflectante, las variaciones de intensidad debidas a la interferencia destructiva de esta interfaz se pueden utilizar para calcular con precisión de angstrom la posición de los fluoróforos dentro de la bicapa. [21] Tanto las técnicas evanescentes como las de interferencia ofrecen resolución por debajo de la longitud de onda en una sola dimensión (zo vertical). En muchos casos, esta resolución es todo lo que se necesita. Después de todo, las bicapas son muy pequeñas sólo en una dimensión. Lateralmente, una bicapa puede extenderse por muchos micrómetros o incluso milímetros. Pero ciertos fenómenos como el reordenamiento dinámico de fases ocurren en bicapas en una escala de longitud submicrométrica lateral. Un enfoque prometedor para estudiar estas estructuras es la microscopía óptica de barrido de campo cercano (NSOM). [22] Al igual que AFM, NSOM se basa en el escaneo de una punta micromecanizada para proporcionar una señal altamente localizada. Pero a diferencia del AFM, NSOM utiliza una interacción óptica en lugar de física con la muestra, lo que potencialmente perturba las estructuras delicadas en menor medida.

Otra capacidad importante de las bicapas soportadas es la capacidad de modelar la superficie para producir múltiples regiones aisladas en el mismo sustrato. Este fenómeno se demostró por primera vez utilizando rayones o “corrales” metálicos para evitar la mezcla entre regiones adyacentes y al mismo tiempo permitir la libre difusión dentro de cualquier región. [23] [24] Trabajos posteriores ampliaron este concepto mediante la integración de microfluidos para demostrar que se podrían formar gradientes de composición estables en bicapas, [25] permitiendo potencialmente estudios masivos paralelos de segregación de fases, unión molecular y respuesta celular a membranas lipídicas artificiales. La utilización creativa del concepto de corral también ha permitido estudios de la reorganización dinámica de las proteínas de membrana en la interfaz sináptica . [26]
Una de las principales limitaciones de las bicapas soportadas es la posibilidad de interacciones no deseadas con el sustrato. Aunque las bicapas soportadas generalmente no tocan directamente la superficie del sustrato, están separadas sólo por una brecha de agua muy delgada. El tamaño y la naturaleza de este espacio dependen del material del sustrato [27] y de las especies de lípidos, pero generalmente es de aproximadamente 1 nm para los lípidos zwitteriónicos soportados sobre sílice , el sistema experimental más común. [28] [29] Debido a que esta capa es tan delgada, existe un acoplamiento hidrodinámico extenso entre la bicapa y el sustrato, lo que resulta en un coeficiente de difusión más bajo en las bicapas soportadas que en las bicapas libres de la misma composición. [30] Un cierto porcentaje de la bicapa soportada también estará completamente inmóvil, aunque la naturaleza exacta y el motivo de estos sitios "fijados" aún son inciertos. Para bicapas soportadas en fase líquida de alta calidad, la fracción inmóvil suele ser de alrededor del 1-5%. Para cuantificar el coeficiente de difusión y la fracción móvil, los investigadores que estudian bicapas soportadas suelen informar datos FRAP .
Las interacciones de sustrato no deseadas son un problema mucho mayor cuando se incorporan proteínas integrales de membrana, particularmente aquellas con grandes dominios que sobresalen más allá del núcleo de la bicapa. Debido a que la brecha entre la bicapa y el sustrato es tan delgada, estas proteínas a menudo se desnaturalizan en la superficie del sustrato y, por lo tanto, pierden toda funcionalidad. [31] Un enfoque para evitar este problema es el uso de bicapas unidas a polímeros. En estos sistemas, la bicapa está soportada por una red suelta de polímeros hidratados o hidrogel que actúa como espaciador y teóricamente previene las interacciones desnaturalizantes del sustrato. [32] En la práctica, un porcentaje de las proteínas aún perderá movilidad y funcionalidad, probablemente debido a interacciones con los anclajes de polímero/lípido. [30] La investigación en esta área está en curso.
El uso de una membrana lipídica bicapa atada (t-BLM) aumenta aún más la estabilidad de las membranas soportadas al anclar químicamente los lípidos al sustrato sólido. [33]

El oro se puede utilizar como sustrato debido a su química inerte y a sus tiolípidos para la unión covalente al oro. Los tiolípidos están compuestos de derivados lipídicos, extendidos en sus grupos de cabeza polares por espaciadores hidrófilos que terminan en un grupo tiol o disulfuro que forma un enlace covalente con el oro, formando monocapas autoensambladas (SAM).
La limitación de la movilidad intramembrana de las bicapas lipídicas soportadas se puede superar mediante la introducción de lípidos de fijación que abarcan la media membrana [34] con disulfuro de bencilo (DPL) y lípidos que abarcan la membrana completa de un análogo sintético de arqueas con cadenas de fitanolio para estabilizar la estructura y las unidades de polietilenglicol. como espaciador hidrófilo. La formación de bicapa se logra mediante la exposición del sustrato de oro recubierto de lípidos a los lípidos de la capa externa, ya sea en una solución de etanol o en liposomas. [35]
La ventaja de este enfoque es que debido al espacio hidrófilo de alrededor de 4 nm, la interacción con el sustrato es mínima y el espacio adicional permite la introducción de canales iónicos de proteínas en la bicapa. Además, la capa espaciadora crea un depósito iónico [36] que permite fácilmente la medición de la impedancia eléctrica de CA a través de la bicapa.
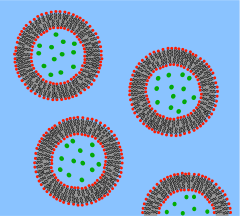
Una vesícula es una bicapa lipídica enrollada en una capa esférica, que encierra una pequeña cantidad de agua y la separa del agua fuera de la vesícula. Debido a esta similitud fundamental con la membrana celular, las vesículas se han utilizado ampliamente para estudiar las propiedades de las bicapas lipídicas. Otra razón por la que las vesículas se han utilizado con tanta frecuencia es que son relativamente fáciles de fabricar. Si una muestra de lípidos deshidratados se expone al agua, formará vesículas espontáneamente. [37] Estas vesículas iniciales son típicamente multilaminares (con muchas paredes) y tienen una amplia gama de tamaños, desde decenas de nanómetros hasta varios micrómetros. [38] Se necesitan métodos como la sonicación o la extrusión a través de una membrana para romper estas vesículas iniciales en vesículas más pequeñas, de pared simple y de diámetro uniforme, conocidas como pequeñas vesículas unilaminares (SUV). Los SUV suelen tener diámetros de entre 50 y 200 nm. [39] Alternativamente, en lugar de sintetizar vesículas, es posible simplemente aislarlas de cultivos celulares o muestras de tejido. [40] Las vesículas se utilizan para transportar lípidos, proteínas y muchas otras moléculas dentro de la célula, así como dentro o fuera de la célula. Estas vesículas aisladas naturalmente están compuestas por una mezcla compleja de diferentes lípidos y proteínas por lo que, aunque ofrecen mayor realismo para estudiar fenómenos biológicos específicos, se prefieren vesículas artificiales simples para estudios de propiedades lipídicas fundamentales.
Dado que los SUV artificiales se pueden fabricar en grandes cantidades, son adecuados para estudios de materiales a granel, como la difracción de rayos X para determinar el espaciado de la red [41] y la calorimetría diferencial de barrido para determinar las transiciones de fase. [42] La interferometría de polarización dual puede medir estructuras unilamelares y multilamelares y la inserción y alteración de las vesículas en un formato de ensayo sin etiquetas. [43] Las vesículas también se pueden marcar con colorantes fluorescentes para permitir ensayos de fusión sensibles basados en FRET . [44]
A pesar de las etiquetas fluorescentes, a menudo resulta difícil obtener imágenes detalladas en los SUV simplemente porque son muy pequeños. Para combatir este problema, los investigadores utilizan vesículas unilaminares gigantes (GUV). Las GUV son lo suficientemente grandes (1 - 200 µm) para estudiarlas mediante microscopía de fluorescencia tradicional y están dentro del mismo rango de tamaño que la mayoría de las células biológicas. Por tanto, se utilizan como mimetismos de membranas celulares para estudios in vitro en biología molecular y celular. Muchos de los estudios de balsas lipídicas en sistemas lipídicos artificiales se han realizado con GUV por este motivo. [45] En comparación con las bicapas soportadas, las GUV presentan un entorno más "natural" ya que no hay una superficie rígida que pueda inducir defectos, afectar las propiedades de la membrana o desnaturalizar las proteínas. Por lo tanto, las GUV se utilizan con frecuencia para estudiar la remodelación de la membrana y otras interacciones proteína-membrana in vitro. Existe una variedad de métodos para encapsular proteínas u otros reactivos biológicos dentro de dichas vesículas, lo que convierte a los GUV en un sistema ideal para la recreación (e investigación) in vitro de funciones celulares en entornos de membrana modelo similares a células. [46] Estos métodos incluyen métodos de microfluidos, que permiten una producción de alto rendimiento de vesículas con tamaños consistentes. [47]
Las bicapas de interfaz de gotitas (DIB) son gotitas recubiertas de fosfolípidos que forman bicapas cuando se ponen en contacto. [48] [49] Las gotitas están rodeadas de aceite y los fosfolípidos están dispersos en el agua o en el aceite. [48] Como resultado, los fosfolípidos forman espontáneamente una monocapa en cada una de las interfaces aceite-agua. [48] Los DIB se pueden formar para crear material similar a un tejido con la capacidad de formar bicapas asimétricas, reconstituir proteínas y canales de proteínas o usarse en el estudio de electrofisiología. [50] [51] [52] [53] [54] Las redes DIB extendidas se pueden formar empleando dispositivos de microfluidos de gotas o impresoras de gotas. [54] [55]
Las micelas de detergente [56] son otra clase de membranas modelo que se usan comúnmente para purificar y estudiar proteínas de membrana , aunque carecen de una bicapa lipídica. En soluciones acuosas, las micelas son conjuntos de moléculas anfipáticas con sus cabezas hidrófilas expuestas al disolvente y sus colas hidrófobas en el centro. Las micelas pueden solubilizar proteínas de membrana encapsulándolas parcialmente y protegiendo sus superficies hidrofóbicas del disolvente.
Las bicelas son una clase relacionada de membrana modelo, [57] típicamente formadas por dos lípidos, uno de los cuales forma una bicapa lipídica mientras que el otro forma un conjunto anfipático similar a una micela que protege el centro de la bicapa de las moléculas de disolvente circundantes. Las bicelas pueden considerarse como un segmento de bicapa encapsulado y solubilizado por una micela. Las bicelas son mucho más pequeñas que los liposomas y, por lo tanto, pueden usarse en experimentos como la espectroscopia de RMN, donde las vesículas más grandes no son una opción.
Los nanodiscos [58] consisten en un segmento de bicapa encapsulado por una cubierta de proteína anfipática, en lugar de una capa lipídica o detergente. Los nanodiscos son más estables que las bicelas y micelas a bajas concentraciones y tienen un tamaño muy definido (dependiendo del tipo de cubierta proteica, entre 10 y 20 nm ). Las proteínas de membrana incorporadas y solubilizadas por nanodiscos se pueden estudiar mediante una amplia variedad de técnicas biofísicas. [59] [60]