Un ciclo de Carnot es un ciclo termodinámico ideal propuesto por el físico francés Sadi Carnot en 1824 y ampliado por otros en las décadas de 1830 y 1840. Según el teorema de Carnot , proporciona un límite superior a la eficiencia de cualquier motor termodinámico clásico durante la conversión de calor en trabajo , o por el contrario, la eficiencia de un sistema de refrigeración al crear una diferencia de temperatura mediante la aplicación de trabajo al sistema.
En un ciclo de Carnot, un sistema o motor transfiere energía en forma de calor entre dos depósitos térmicos a temperaturas y (denominados depósitos fríos y calientes, respectivamente), y una parte de esta energía transferida se convierte en trabajo realizado por el sistema. El ciclo es reversible y la entropía se conserva , simplemente se transfiere entre los depósitos térmicos y el sistema sin ganancia ni pérdida. Cuando se aplica trabajo al sistema, el calor pasa del depósito frío al caliente ( bomba de calor o refrigeración ). Cuando el calor pasa del depósito caliente al frío, el sistema aplica trabajo al medio ambiente. El trabajo realizado por el sistema o motor al medio ambiente por ciclo de Carnot depende de las temperaturas de los depósitos térmicos y de la entropía transferida del depósito caliente al sistema por ciclo, como por ejemplo , dónde se transfiere el calor del depósito caliente al sistema por ciclo. ciclo.
Un ciclo de Carnot como ciclo termodinámico idealizado realizado por una máquina térmica de Carnot , que consta de los siguientes pasos:

Expansión isotérmica . El calor (como energía) se transfiere reversiblemente desde un depósito de temperatura caliente a temperatura constante T H al gas a una temperatura infinitamente menor que T H (para permitir la transferencia de calor al gas sin cambiar prácticamente la temperatura del gas, por lo que se agrega o absorbe calor isotérmicamente ). Durante este paso (1 a 2 en la Figura 1 , A a B en la Figura 2 ), el gas está térmicamente en contacto con el depósito de temperatura caliente (mientras está térmicamente aislado del depósito de temperatura fría) y se permite que el gas se expanda, realizando trabajo. en los alrededores mediante gas que empuja hacia arriba el pistón (figura de la etapa 1, derecha). Aunque la presión cae de los puntos 1 a 2 (figura 1), la temperatura del gas no cambia durante el proceso porque el calor transferido desde el depósito de temperatura caliente al gas se utiliza exactamente para realizar trabajo en los alrededores por parte del gas, por lo que No hay cambios en la energía interna del gas (no hay cambios en la temperatura del gas para un gas ideal). El calor Q H > 0 se absorbe del depósito de temperatura caliente, lo que da como resultado un aumento en la entropíadel gas en la cantidad.
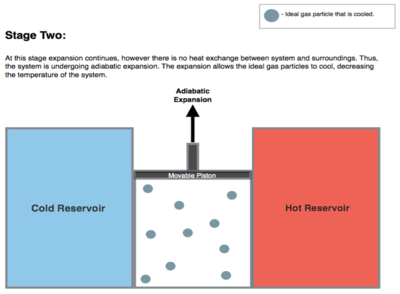
Expansión isentrópica ( adiabática reversible ) del gas (producción de trabajo isentrópica). Para este paso (2 a 3 en la Figura 1 , B a C en la Figura 2 ), el gas en el motor está aislado térmicamente de los depósitos frío y caliente, por lo que no ganan ni pierden calor, un proceso " adiabático ". El gas continúa expandiéndose al reducirse su presión, realizando trabajo en los alrededores (levantando el pistón; figura de la etapa 2, derecha) y perdiendo una cantidad de energía interna igual al trabajo realizado. La expansión del gas sin aporte de calor hace que el gas se enfríe a una temperatura "fría" (al perder su energía interna), que es infinitamente mayor que la temperatura fría del yacimiento T C . La entropía permanece sin cambios ya que no se transfiere calor Q ( Q = 0) entre el sistema (el gas) y sus alrededores, por lo que se trata de un proceso isentrópico, lo que significa que no hay cambio de entropía en el proceso.

Compresión isotérmica. Calor transferido de forma reversible a un depósito de baja temperatura a temperatura constante T C (rechazo de calor isotérmico). En este paso (3 a 4 en la Figura 1 , C a D en la Figura 2 ), el gas en el motor está en contacto térmico con el depósito frío a la temperatura T C (mientras está aislado térmicamente del depósito de temperatura caliente) y la temperatura del gas es infinitamente mayor que esta temperatura (para permitir la transferencia de calor del gas al depósito frío sin cambiar prácticamente la temperatura del gas). Los alrededores trabajan sobre el gas, empujando el pistón hacia abajo (figura de la etapa 3, derecha). Una cantidad de energía obtenida por el gas a partir de este trabajo se transfiere exactamente como energía térmica Q C < 0 (negativa al salir del sistema, según la convención universal en termodinámica ) al depósito frío, por lo que la entropía del sistema disminuye en la proporción cantidad . [1] porque la compresión isotérmica disminuye la multiplicidad del gas.

Compresión isentrópica. (4 a 1 en la Figura 1 , D a A en la Figura 2 ) Una vez más, el gas en el motor está aislado térmicamente de los depósitos frío y caliente, y se supone que el motor no tiene fricción y que el proceso es lo suficientemente lento y, por lo tanto, reversible. Durante este paso, los alrededores trabajan sobre el gas, empujando el pistón hacia abajo más (figura de la etapa 4, derecha), aumentando su energía interna, comprimiéndolo y provocando que su temperatura vuelva a subir a una temperatura infinitamente menor que T H debido únicamente al trabajo agregado al sistema, pero la entropía permanece sin cambios. En este punto el gas está en el mismo estado que al inicio del paso 1.
En este caso, dado que se trata de un ciclo termodinámico reversible (sin cambio neto en el sistema y sus alrededores por ciclo) [2] [1]
Esto es cierto ya que y son de menor magnitud y, de hecho, están en la misma proporción que .
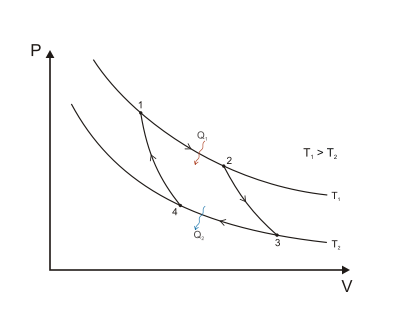
Cuando se traza un ciclo de Carnot en un diagrama de presión-volumen ( Figura 1 ), las etapas isotérmicas siguen las líneas isotérmicas del fluido de trabajo, las etapas adiabáticas se mueven entre isotermas y el área delimitada por la trayectoria del ciclo completo representa el trabajo total que se puede realizar durante un ciclo. Del punto 1 al 2 y del punto 3 al 4 la temperatura es constante (proceso isotérmico). La transferencia de calor del punto 4 al 1 y del punto 2 al 3 es igual a cero (proceso adiabático).


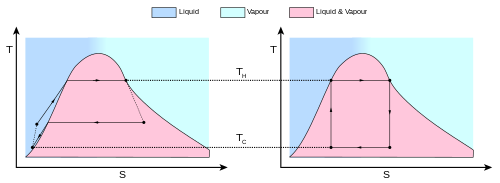
El comportamiento de un motor o refrigerador de Carnot se comprende mejor utilizando un diagrama de temperatura-entropía ( diagrama T – S ), en el que el estado termodinámico se especifica mediante un punto en un gráfico con la entropía ( S ) como eje horizontal y la temperatura ( T ) como eje vertical ( Figura 2 ). Para un sistema cerrado simple (análisis de masa de control), cualquier punto del gráfico representa un estado particular del sistema. Un proceso termodinámico está representado por una curva que conecta un estado inicial (A) y un estado final (B). El área bajo la curva es:
que es la cantidad de calor transferido en el proceso. Si el proceso mueve el sistema a una mayor entropía, el área bajo la curva es la cantidad de calor absorbida por el sistema en ese proceso; de lo contrario, es la cantidad de calor que se elimina o sale del sistema. Para cualquier proceso cíclico, hay una parte superior del ciclo y una parte inferior. En los diagramas T - S para un ciclo en el sentido de las agujas del reloj, el área debajo de la parte superior será la energía absorbida por el sistema durante el ciclo, mientras que el área debajo de la parte inferior será la energía eliminada del sistema durante el ciclo. El área dentro del ciclo es entonces la diferencia entre ambos (la energía calorífica neta absorbida), pero como la energía interna del sistema debe haber regresado a su valor inicial, esta diferencia debe ser la cantidad de trabajo realizado por el sistema por ciclo. . Con referencia a la Figura 1 , matemáticamente, para un proceso reversible, podemos escribir la cantidad de trabajo realizado durante un proceso cíclico como:
Dado que dU es un diferencial exacto , su integral sobre cualquier circuito cerrado es cero y se deduce que el área dentro del circuito en un diagrama T – S es (a) igual al trabajo total realizado por el sistema en los alrededores si el circuito es se recorre en el sentido de las agujas del reloj, y (b) es igual al trabajo total realizado sobre el sistema por los alrededores a medida que el bucle se recorre en el sentido contrario a las agujas del reloj.


La evaluación de la integral anterior es particularmente sencilla para un ciclo de Carnot. La cantidad de energía transferida como trabajo es
La cantidad total de calor transferida desde el depósito caliente al sistema (en la expansión isotérmica) será
Debido a la conservación de energía, el calor neto transferido, es igual al trabajo realizado [1]
La eficiencia se define como:
dónde
La expresión con la temperatura se puede derivar de las expresiones anteriores con la entropía: y . Desde entonces , aparece un signo menos en la expresión final de .
Esta es la definición de eficiencia de trabajo del motor térmico de Carnot como la fracción del trabajo realizado por el sistema respecto de la energía térmica recibida por el sistema del depósito caliente por ciclo. Esta energía térmica es la iniciadora del ciclo.
El ciclo de una máquina térmica de Carnot descrito es un ciclo totalmente reversible. Es decir, todos los procesos que lo componen se pueden revertir, en cuyo caso se convierte en el ciclo de bomba de calor y refrigeración de Carnot . Esta vez, el ciclo sigue siendo exactamente el mismo excepto que las direcciones de cualquier interacción de calor y trabajo se invierten. El calor se absorbe del depósito de baja temperatura, el calor se rechaza a un depósito de alta temperatura y se requiere un aporte de trabajo para lograr todo esto. El diagrama P – V del ciclo de Carnot invertido es el mismo que el del ciclo de la máquina térmica de Carnot, excepto que las direcciones de los procesos se invierten. [3]
Se puede ver en el diagrama anterior que para cualquier ciclo que funcione entre temperaturas y , ninguno puede exceder la eficiencia de un ciclo de Carnot.
El teorema de Carnot es una declaración formal de este hecho: ningún motor que funcione entre dos depósitos de calor puede ser más eficiente que un motor de Carnot que funcione entre esos mismos depósitos. Por tanto, la Ecuación 3 proporciona la máxima eficiencia posible para cualquier motor utilizando las temperaturas correspondientes. Un corolario del teorema de Carnot establece que: Todos los motores reversibles que funcionan entre los mismos depósitos de calor son igualmente eficientes. Reorganizar el lado derecho de la ecuación da lo que puede ser una forma más fácil de entender de la ecuación, es decir, que la eficiencia máxima teórica de un motor térmico es igual a la diferencia de temperatura entre el depósito caliente y el frío dividida por la temperatura absoluta del depósito caliente. . Al observar esta fórmula, se hace evidente un hecho interesante: bajar la temperatura del depósito frío tendrá más efecto en la eficiencia máxima de un motor térmico que aumentar la temperatura del depósito caliente en la misma cantidad. En el mundo real, esto puede resultar difícil de lograr, ya que la reserva fría suele ser la temperatura ambiente existente.
En otras palabras, la máxima eficiencia se logra si y sólo si la entropía no cambia por ciclo. Se produce un cambio de entropía por ciclo, por ejemplo, si hay fricción que conduce a la disipación del trabajo en calor. En ese caso, el ciclo no es reversible y el teorema de Clausius se convierte en una desigualdad en lugar de una igualdad. De lo contrario, dado que la entropía es una función de estado , el vertido de calor necesario al medio ambiente para eliminar el exceso de entropía conduce a una reducción (mínima) de la eficiencia. Entonces, la Ecuación 3 da la eficiencia de cualquier máquina térmica reversible .
En los motores térmicos mesoscópicos, el trabajo por ciclo de operación en general fluctúa debido al ruido térmico. Si el ciclo se realiza de forma casi estática, las fluctuaciones desaparecen incluso en la mesoescala. [4] Sin embargo, si el ciclo se realiza más rápido que el tiempo de relajación del medio de trabajo, las fluctuaciones de trabajo son inevitables. Sin embargo, cuando se cuentan las fluctuaciones de trabajo y calor, una igualdad exacta relaciona el promedio exponencial del trabajo realizado por cualquier máquina térmica con la transferencia de calor desde el baño térmico más caliente. [5]
Carnot se dio cuenta de que, en realidad, no es posible construir un motor termodinámicamente reversible . Por tanto, los motores térmicos reales son incluso menos eficientes de lo que indica la Ecuación 3 . Además, los motores reales que funcionan según el estilo del ciclo de Carnot (expansión isotérmica/expansión isentrópica/compresión isotérmica/compresión isentrópica) son raros. Sin embargo, la Ecuación 3 es extremadamente útil para determinar la eficiencia máxima que podría esperarse para un conjunto determinado de yacimientos térmicos.
Aunque el ciclo de Carnot es una idealización, la Ecuación 3 como expresión de la eficiencia de Carnot sigue siendo útil. Considere las temperaturas promedio ,
Para el ciclo de Carnot, o su equivalente, el valor promedio ⟨ T H ⟩ será igual a la temperatura más alta disponible, es decir, T H , y ⟨ T C ⟩ la más baja, es decir , T C. Para otros ciclos termodinámicos menos eficientes, ⟨ T H ⟩ será menor que TH y ⟨ T C ⟩ será mayor que T C . Esto puede ayudar a ilustrar, por ejemplo, por qué un recalentador o un regenerador puede mejorar la eficiencia térmica de las centrales eléctricas de vapor y por qué la eficiencia térmica de las centrales eléctricas de ciclo combinado (que incorporan turbinas de gas que funcionan a temperaturas aún más altas) supera la de las centrales eléctricas de vapor convencionales. plantas. El primer prototipo de motor diésel se basó en los principios del ciclo de Carnot.
La máquina térmica de Carnot es, en definitiva, una construcción teórica basada en un sistema termodinámico idealizado . A nivel práctico a escala humana, el ciclo de Carnot ha demostrado ser un modelo valioso, como para avanzar en el desarrollo del motor diésel . Sin embargo, a escala macroscópica, las limitaciones impuestas por los supuestos del modelo lo demuestran poco práctico y, en última instancia, incapaz de realizar ningún trabajo . [6] Como tal, según el teorema de Carnot , el motor de Carnot puede considerarse como el límite teórico de los motores térmicos a escala macroscópica en lugar de cualquier dispositivo práctico que pueda construirse. [7]
... desde la máquina térmica de Carnot, establecer un límite superior en la eficiencia de una máquina térmica es un motor ideal y reversible del cual se debe realizar un solo ciclo en un tiempo infinito, lo cual no es práctico y, por lo tanto, la máquina de Carnot tiene potencia cero.
Sin embargo, las fluctuaciones [en la temperatura del yacimiento] hacen que estos motores no sean prácticos.