
En química orgánica , las reacciones queletrópicas , también conocidas como reacciones quelotrópicas , [2] son un tipo de reacción pericíclica (una reacción química que implica un estado de transición con una matriz cíclica de átomos y una matriz cíclica asociada de orbitales interactuantes ). [1] Específicamente, las reacciones queletrópicas son una subclase de cicloadiciones . La característica distintiva clave de las reacciones queletrópicas es que en uno de los reactivos , ambos enlaces nuevos se están realizando al mismo átomo. [3]
En el estado de transición pericíclico, una molécula pequeña dona dos electrones al anillo. El proceso de reacción se puede mostrar utilizando dos geometrías diferentes: la molécula pequeña puede aproximarse de forma lineal o no lineal. En la aproximación lineal, los electrones en el orbital de la molécula pequeña apuntan directamente al sistema π. En la aproximación no lineal, el orbital se aproxima en un ángulo oblicuo. La capacidad del sistema π de rotar a medida que la molécula pequeña se aproxima es crucial para formar nuevos enlaces. La dirección de rotación será diferente según la cantidad de electrones π que haya en el sistema. A continuación se muestra un diagrama de un fragmento de dos electrones que se aproxima a un sistema π de cuatro electrones utilizando orbitales moleculares de frontera. La rotación será disrotatoria si la molécula pequeña se aproxima linealmente y conrotatoria si la molécula se aproxima de forma no lineal. Disrotatoria y conrotatoria son términos sofisticados que expresan cómo rotan los enlaces en el sistema π. Disrotatorio significa direcciones opuestas, mientras que conrotatorio significa la misma dirección. Esto también se muestra en el diagrama a continuación.
Usando la regla de Hückel , se puede determinar si el sistema π es aromático o antiaromático. Si es aromático, los enfoques lineales utilizan un movimiento disrotatorio mientras que los enfoques no lineales utilizan un movimiento conrotatorio. Lo opuesto sucede con un sistema antiaromático. Los enfoques lineales tendrán un movimiento conrotatorio mientras que los enfoques no lineales tendrán un movimiento disrotatorio. [1]
En 1995, Suárez y Sordo demostraron que el dióxido de azufre cuando reacciona con butadieno e isopreno da dos productos diferentes dependiendo del mecanismo. Esto se demostró experimentalmente y utilizando cálculos ab initio . Son posibles tanto un producto cinético como un producto termodinámico, pero el producto termodinámico es más favorable. El producto cinético surge de una reacción de Diels-Alder , mientras que una reacción queletrópica da lugar a un producto termodinámicamente más estable. La vía queletrópica es la preferida porque da lugar a un aducto de anillo de cinco miembros más estable. El siguiente esquema muestra la diferencia entre los dos productos, la vía de la derecha muestra el producto termodinámico más estable, mientras que la vía de la izquierda muestra el producto cinético. [4]
Las reacciones queletrópicas de 1,3-dienos con dióxido de azufre se han investigado ampliamente en términos de cinética (ver más arriba la reacción general).
En la primera medición cuantitativa de los parámetros cinéticos de esta reacción, un estudio de 1976 realizado por Isaacs y Laila midió las velocidades de adición de dióxido de azufre a los derivados del butadieno. Las velocidades de adición se controlaron en benceno a 30 °C con un exceso inicial de dióxido de azufre de veinte veces, lo que permitió una aproximación pseudo de primer orden. La desaparición de SO 2 se siguió espectrofotométricamente a 320 nm. La reacción mostró una cinética pseudo de primer orden. Algunos resultados interesantes fueron que los grupos atractores de electrones en el dieno disminuyeron la velocidad de reacción. Además, la velocidad de reacción se vio afectada considerablemente por los efectos estéricos de los sustituyentes 2, y los grupos más voluminosos aumentaron la velocidad de reacción. Los autores atribuyen esto a la tendencia de los grupos voluminosos a favorecer la conformación cisoide del dieno, que es esencial para la reacción (véase la tabla siguiente). Además, se midieron las velocidades a cuatro temperaturas para siete de los dienos, lo que permitió calcular la entalpía de activación (ΔH ‡ ) y la entropía de activación (ΔS ‡ ) para estas reacciones a través de la ecuación de Arrhenius . [5]
Más recientemente, un estudio de 2002 realizado por Monnat, Vogel y Sordo midió la cinética de adición de dióxido de azufre a 1,2-dimetilidenocicloalcanos. Un punto interesante presentado en este artículo es que la reacción de 1,2-dimetilidenociclohexano con dióxido de azufre puede dar dos productos diferentes dependiendo de las condiciones de reacción. La reacción produce la sulfina correspondiente a través de una reacción hetero-Diels-Alder bajo control cinético (≤ -60 °C), pero, bajo control termodinámico (≥ -40 °C), la reacción produce el sulfoleno correspondiente a través de una reacción queletrópica. La entalpía de activación para la reacción hetero-Diels-Alder es aproximadamente 8 kJ / mol menor que la de la reacción queletrópica correspondiente. El sulfoleno es aproximadamente 40 kJ/mol más estable que la sulfina isométrica en solución de CH2Cl2 / SO2 . [ 6]
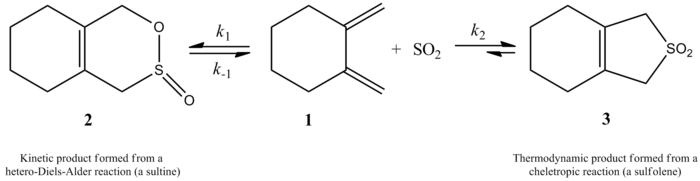
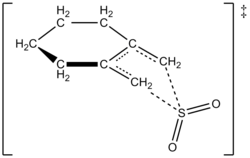
Los autores pudieron determinar experimentalmente una ley de velocidad a 261,2 K para la reacción de 1,2-dimetilidenociclohexano con dióxido de azufre para dar el sulfoleno correspondiente. La reacción fue de primer orden en 1,2-dimetilidenociclohexano pero de segundo orden en dióxido de azufre (ver abajo). Esto confirmó una predicción basada en cálculos cuánticos ab initio de alto nivel. Usando métodos computacionales, los autores propusieron una estructura de transición para la reacción quelotrópica de 1,2-dimetilidenociclohexano con dióxido de azufre (ver figura a la derecha). [6] La reacción es de segundo orden en dióxido de azufre porque otra molécula de dióxido de azufre probablemente se une al estado de transición para ayudar a estabilizarlo. [7] Resultados similares fueron encontrados en un estudio de 1995 por Suarez, Sordo y Sordo que usó cálculos ab initio para estudiar el control cinético y termodinámico de la reacción de dióxido de azufre con 1,3-dienos. [4]
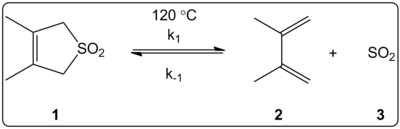
Se investigó cinéticamente el efecto del disolvente de la reacción quelotrópica de 3,4-dimetil-2,5-dihidrotiofen-1,1-dióxido (mostrado a la derecha) en 14 disolventes. Se descubrió que las constantes de velocidad de reacción de la reacción directa e inversa, además de las constantes de equilibrio, estaban correlacionadas linealmente con la escala de polaridad del disolvente E T (30).
Las reacciones se realizaron a 120 °C y se estudiaron mediante espectroscopia de RMN de 1H de la mezcla de reacción. Se encontró que la velocidad directa k 1 disminuía en un factor de 4,5 al pasar del ciclohexano al metanol . Se encontró que la velocidad inversa k −1 aumentaba en un factor de 53 al pasar del ciclohexano al metanol , mientras que la constante de equilibrio K eq disminuía en un factor de 140. Se sugiere que hay un cambio de polaridad durante el proceso de activación como lo evidencian las correlaciones entre los datos de equilibrio y cinéticos. Los autores comentan que la reacción parece estar influenciada por la polaridad del disolvente, y esto puede explicarse por el cambio en los momentos dipolares al pasar del estado reactivo al estado de transición al producto. Los autores también afirman que la reacción queletrópica no parece estar influenciada ni por la acidez ni por la basicidad del disolvente.
Los resultados de este estudio llevan a los autores a esperar los siguientes comportamientos:
1. El cambio en la polaridad del disolvente influirá en la velocidad menos que el equilibrio.
2. Las constantes de velocidad se caracterizarán por un efecto opuesto sobre la polaridad: k 1 disminuirá ligeramente con el aumento de E T (30), y k −1 aumentará en las mismas condiciones.
3. El efecto sobre k −1 será mayor que sobre k 1 . [8]
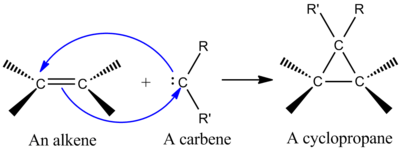
Una de las reacciones quelotrópicas más importantes desde el punto de vista sintético es la adición de un carbeno singlete a un alqueno para formar un ciclopropano (véase la figura de la izquierda). [1] Un carbeno es una molécula neutra que contiene un carbono divalente con seis electrones en su capa de valencia. Debido a esto, los carbenos son electrófilos altamente reactivos y se generan como intermediarios de reacción. [9] Un carbeno singlete contiene un orbital p vacío y un orbital híbrido aproximadamente sp 2 que tiene dos electrones. Los carbenos singlete se añaden estereoespecíficamente a los alquenos, y la estereoquímica del alqueno se conserva en el producto de ciclopropano. [1] El mecanismo para la adición de un carbeno a un alqueno es una cicloadición concertada [2+1] (véase la figura). Los carbenos derivados del cloroformo o bromoformo se pueden utilizar para añadir CX 2 a un alqueno para dar un dihalociclopropano, mientras que el reactivo de Simmons-Smith añade CH 2 . [10]

La interacción del orbital p vacío del carbeno con el sistema π del alqueno crea un sistema de cuatro electrones y favorece un enfoque no lineal. También es favorable mezclar el orbital p vacío del carbeno con el orbital π lleno del alqueno. La mezcla favorable se produce mediante un enfoque no lineal (véase la figura de la derecha). Sin embargo, aunque la teoría claramente favorece un enfoque no lineal, no hay implicaciones experimentales obvias para un enfoque lineal frente a un enfoque no lineal. [1]