El término química bioortogonal se refiere a cualquier reacción química que puede ocurrir dentro de sistemas vivos sin interferir con los procesos bioquímicos nativos. [1] [2] [3] El término fue acuñado por Carolyn R. Bertozzi en 2003. [4] [5] Desde su introducción, el concepto de reacción bioortogonal ha permitido el estudio de biomoléculas como glicanos , proteínas , [6] y lípidos [7] en tiempo real en sistemas vivos sin toxicidad celular. Se han desarrollado varias estrategias de ligadura química que cumplen con los requisitos de bioortogonalidad, incluida la cicloadición 1,3-dipolar entre azidas y ciclooctinas (también denominada química de clic sin cobre ), [8] entre nitronas y ciclooctinas, [9] la formación de oxima / hidrazona a partir de aldehídos y cetonas , [10] la ligadura de tetrazina , [11] la reacción de clic basada en isocianuro , [12] y, más recientemente, la ligadura de cuadriciclano . [13]

El uso de la química bioortogonal se lleva a cabo normalmente en dos pasos. En primer lugar, se modifica un sustrato celular con un grupo funcional bioortogonal (reportero químico) y se introduce en la célula; los sustratos incluyen metabolitos , inhibidores de enzimas, etc. El reportero químico no debe alterar drásticamente la estructura del sustrato para evitar afectar su bioactividad. En segundo lugar, se introduce una sonda que contiene el grupo funcional complementario para que reaccione y marque el sustrato.
Aunque se han desarrollado reacciones bioortogonales eficaces, como la química clic sin cobre , el desarrollo de nuevas reacciones continúa generando métodos ortogonales de etiquetado que permiten utilizar múltiples métodos de etiquetado en los mismos biosistemas. Carolyn R. Bertozzi recibió el Premio Nobel de Química en 2022 por su desarrollo de la química clic y la química bioortogonal. [14]
La palabra bioortogonal proviene del griego bio- "vivo" y orthogōnios "rectangular". Por lo tanto, literalmente, se trata de una reacción que se desarrolla de manera perpendicular a un sistema vivo, sin perturbarlo.
Para ser considerada bioortogonal, una reacción debe cumplir una serie de requisitos:
La ligación de Staudinger es una reacción desarrollada por el grupo Bertozzi en el año 2000 que se basa en la reacción clásica de Staudinger de azidas con triarilfosfinas. [15] Inauguró el campo de la química bioortogonal como la primera reacción con grupos funcionales completamente abióticos, aunque ya no se utiliza tan ampliamente. La ligación de Staudinger se ha utilizado tanto en células vivas como en ratones vivos. [5]
La azida puede actuar como un electrófilo blando que prefiere nucleófilos blandos como las fosfinas . Esto contrasta con la mayoría de los nucleófilos biológicos que son típicamente nucleófilos duros. La reacción se lleva a cabo de forma selectiva en condiciones tolerantes al agua para producir un producto estable.
Las fosfinas están completamente ausentes en los sistemas vivos y no reducen los enlaces disulfuro a pesar de su leve potencial de reducción. Se ha demostrado que las azidas son biocompatibles en medicamentos aprobados por la FDA, como la azidotimidina, y en otros usos como reticulantes. Además, su pequeño tamaño les permite incorporarse fácilmente a las biomoléculas a través de vías metabólicas celulares.
La fosfina nucleófila ataca a la azida en el nitrógeno terminal electrófilo. A través de un estado de transición de cuatro miembros, se pierde N2 para formar un aza-iluro. El iluro inestable se hidroliza para formar óxido de fosfina y una amina primaria. Sin embargo, esta reacción no es inmediatamente bioortogonal porque la hidrólisis rompe el enlace covalente en el aza-iluro.
La reacción se modificó para incluir un grupo éster en posición orto respecto del átomo de fósforo en uno de los anillos arílicos para dirigir el aza-iluro a través de una nueva vía de reactividad con el fin de superar la hidrólisis inmediata posicionando el éster para aumentar la concentración local. El ataque nucleofílico inicial sobre la azida es el paso limitante de la velocidad. El iluro reacciona con la trampa de éster electrofílica a través de la ciclización intramolecular para formar un anillo de cinco miembros. Este anillo sufre hidrólisis para formar un enlace amida estable .
Los reactivos de fosfina sufren una oxidación lenta en el aire en los sistemas vivos. Además, es probable que sean metabolizados in vitro por las enzimas del citocromo P450 .
La cinética de las reacciones es lenta, con constantes de velocidad de segundo orden de alrededor de 0,0020 M −1 •s −1 . Los intentos de aumentar las tasas de ataque nucleofílico mediante la adición de grupos donadores de electrones a las fosfinas mejoraron la cinética, pero también aumentaron la tasa de oxidación del aire.
La mala cinética requiere el uso de altas concentraciones de fosfina, lo que genera problemas con la alta señal de fondo en aplicaciones de imágenes. Se han hecho intentos para combatir el problema de la alta señal de fondo mediante el desarrollo de reactivos de fosfina fluorogénicos basados en fluoresceína y luciferina , pero la cinética intrínseca sigue siendo una limitación. [16]
La química de clic sin cobre es una reacción bioortogonal desarrollada por primera vez por Carolyn Bertozzi como una variante activada de una cicloadición de Huisgen de azida alquino , basada en el trabajo de Karl Barry Sharpless et al. A diferencia de CuAAC, la química de clic sin Cu se ha modificado para que sea bioortogonal eliminando un catalizador de cobre citotóxico, lo que permite que la reacción se desarrolle rápidamente y sin toxicidad para las células vivas. En lugar de cobre, la reacción es una cicloadición de azida-alquino promovida por tensión ( SPAAC ). Se desarrolló como una alternativa más rápida a la ligadura de Staudinger, y las primeras generaciones reaccionaron más de sesenta veces más rápido. La bioortogonalidad de la reacción ha permitido que la reacción de clic sin Cu se aplique en células cultivadas, peces cebra vivos y ratones.
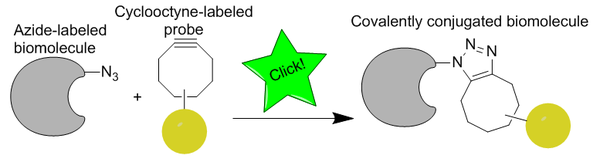
La clásica cicloadición de azida-alquino catalizada por cobre ha sido una reacción de clic extremadamente rápida y eficaz para la bioconjugación, pero no es adecuada para su uso en células vivas debido a la toxicidad de los iones Cu(I). La toxicidad se debe al daño oxidativo de las especies reactivas de oxígeno formadas por los catalizadores de cobre. También se ha descubierto que los complejos de cobre inducen cambios en el metabolismo celular y son absorbidos por las células.
Se han desarrollado algunos ligandos para prevenir el daño a las biomoléculas y facilitar su eliminación en aplicaciones in vitro . Sin embargo, se ha descubierto que diferentes entornos de ligandos de complejos aún pueden afectar el metabolismo y la absorción, introduciendo una perturbación no deseada en la función celular. [17]
El grupo azida es particularmente bioortogonal porque es extremadamente pequeño (favorable para la permeabilidad celular y evita perturbaciones), metabólicamente estable y no existe naturalmente en las células y, por lo tanto, no tiene reacciones secundarias biológicas competitivas. Aunque las azidas no son el 1,3-dipolo más reactivo disponible para la reacción, son preferidas por su relativa falta de reacciones secundarias y estabilidad en condiciones sintéticas típicas. [18] El alquino no es tan pequeño, pero aún tiene la estabilidad y ortogonalidad necesarias para el etiquetado in vivo . Las ciclooctinas son tradicionalmente el cicloalquino más común para estudios de etiquetado, ya que son el anillo de alquino estable más pequeño.
La reacción se desarrolla como una cicloadición 1,3-dipolar estándar, un tipo de desplazamiento pericíclico concertado y asincrónico . La naturaleza ambivalente del 1,3-dipolo debería hacer imposible la identificación de un centro electrofílico o nucleofílico en la azida, de modo que la dirección del flujo cíclico de electrones carece de significado. [p] Sin embargo, los cálculos han demostrado que la distribución de electrones entre los nitrógenos hace que el átomo de nitrógeno más interno tenga la mayor carga negativa. [19]
Aunque la reacción produce una mezcla regioisomérica de triazoles, la falta de regioselectividad en la reacción no es una preocupación importante para la mayoría de las aplicaciones actuales. Los requisitos más regioespecíficos y menos bioortogonales se satisfacen mejor mediante la cicloadición de Huisgen catalizada por cobre, especialmente dada la dificultad sintética (en comparación con la adición de un alquino terminal) de sintetizar un ciclooctino deformado.

El OCT fue el primer ciclooctino desarrollado para la química click sin Cu. Mientras que los alquinos lineales no son reactivos a temperaturas fisiológicas, el OCT pudo reaccionar fácilmente con azidas en condiciones biológicas sin mostrar toxicidad. Sin embargo, era poco soluble en agua y la cinética apenas mejoró con respecto a la ligación de Staudinger. El ALO (octino sin arilo) se desarrolló para mejorar la solubilidad en agua, pero aún tenía una cinética pobre.
Los ciclooctinos monofluorados ( MOFO ) y difluorados ( DIFO ) se crearon para aumentar la velocidad mediante la adición de sustituyentes de flúor que atraen electrones en la posición propargílica . El flúor es un buen grupo que atrae electrones en términos de accesibilidad sintética e inercia biológica. En particular, no puede formar un aceptor de Michael electrofílico que pueda reaccionar de forma secundaria con nucleófilos biológicos. [8] El DIBO (dibenzociclooctino) se desarrolló como una fusión de dos anillos arilo, lo que resultó en una tensión muy alta y una disminución de las energías de distorsión. Se propuso que la sustitución de biarilo aumenta la tensión del anillo y proporciona conjugación con el alquino para mejorar la reactividad. Aunque los cálculos han predicho que la sustitución monoarilo proporcionaría un equilibrio óptimo entre el choque estérico (con la molécula de azida) y la tensión, [20] se ha demostrado que los productos monoarilados son inestables.
BARAC (biarylazacyclooctynone) seguido de la adición de un enlace amida que agrega un centro tipo sp2 para aumentar la velocidad por distorsión. La resonancia de amida aporta tensión adicional sin crear insaturación adicional que conduciría a una molécula inestable. Además, la adición de un heteroátomo en el anillo de ciclooctyno mejora tanto la solubilidad como la farmacocinética de la molécula. BARAC tiene suficiente velocidad (y sensibilidad) hasta el punto de que no es necesario lavar el exceso de sonda para reducir el fondo. Esto lo hace extremadamente útil en situaciones en las que el lavado es imposible, como en la obtención de imágenes en tiempo real o en la obtención de imágenes de animales completos. Aunque BARAC es extremadamente útil, su baja estabilidad requiere que se almacene a 0 °C, protegido de la luz y el oxígeno. [21]
Se realizaron variaciones de ajustes adicionales en BARAC para producir DIBAC/ADIBO para agregar tensión de anillo distal y reducir la estérica alrededor del alquino para aumentar aún más la reactividad. El ceto-DIBO, en el que el grupo hidroxilo se ha convertido en una cetona, tiene un aumento de tres veces en la velocidad debido a un cambio en la conformación del anillo. Los intentos de hacer un difluorobenzociclooctino ( DIFBO ) no tuvieron éxito debido a la inestabilidad.
Los problemas con DIFO en estudios in vivo con ratones ilustran la dificultad de producir reacciones bioortogonales. Aunque DIFO fue extremadamente reactivo en el marcaje de células, tuvo un desempeño deficiente en estudios con ratones debido a la unión con la albúmina sérica . La hidrofobicidad de la ciclooctina promueve el secuestro por membranas y proteínas séricas, lo que reduce las concentraciones biodisponibles. En respuesta, se desarrolló DIMAC (dimetoxiazaciclooctina) para aumentar la solubilidad en agua, la polaridad y la farmacocinética, [22] aunque los esfuerzos en el marcaje bioortogonal de modelos de ratón aún están en desarrollo.
Los esfuerzos computacionales han sido vitales para explicar la termodinámica y la cinética de estas reacciones de cicloadición, lo que ha desempeñado un papel fundamental en la mejora continua de la reacción. Existen dos métodos para activar alquinos sin sacrificar la estabilidad: disminuir la energía del estado de transición o disminuir la estabilidad del reactivo.

Disminución de la estabilidad de los reactivos: Houk [23] ha propuesto que las diferencias en la energía (E d ‡ ) requerida para distorsionar la azida y el alquino en las geometrías del estado de transición controlan las alturas de la barrera para la reacción. La energía de activación (E ‡ ) es la suma de las distorsiones desestabilizadoras y las interacciones estabilizadoras (E i ‡ ). La distorsión más significativa está en el grupo funcional azida con menor contribución de la distorsión alquino. Sin embargo, es solo el ciclooctino el que se puede modificar fácilmente para una mayor reactividad. Las barreras de reacción calculadas para la fenil azida y el acetileno (16,2 kcal/mol) frente al ciclooctino (8,0 kcal/mol) dan como resultado un aumento de velocidad previsto de 10 6 . El ciclooctino requiere menos energía de distorsión (1,4 kcal/mol frente a 4,6 kcal/mol), lo que da como resultado una energía de activación menor a pesar de una energía de interacción menor.
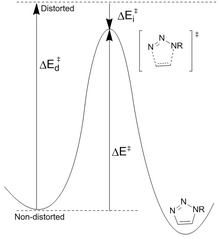
Disminución de la energía del estado de transición: los grupos que extraen electrones, como el flúor, aumentan su velocidad al disminuir la energía LUMO y la brecha HOMO-LUMO. Esto conduce a una mayor transferencia de carga de la azida al ciclooctino fluorado en el estado de transición, lo que aumenta la energía de interacción (menor valor negativo) y la energía de activación general. [24] La disminución del LUMO es el resultado de la hiperconjugación entre los orbitales donantes π del alquino y los aceptores CF σ*. Estas interacciones proporcionan estabilización principalmente en el estado de transición como resultado del aumento de las capacidades donantes/aceptores de los enlaces a medida que se distorsionan. Los cálculos de NBO han demostrado que la distorsión del estado de transición aumenta la energía de interacción en 2,8 kcal/mol.
La hiperconjugación entre enlaces π fuera del plano es mayor porque los enlaces π en el plano están mal alineados. Sin embargo, la flexión del estado de transición permite que los enlaces π en el plano tengan una disposición más antiperiplanar que facilita la interacción. Se logra una estabilización adicional de la energía de interacción hiperconjugativa a través de un aumento en la población electrónica de σ* debido al enlace CN en formación. La hiperconjugación negativa con los enlaces σ* CF mejora esta interacción estabilizadora. [19]
Aunque la regioselectividad no es un gran problema en las aplicaciones actuales de imágenes de la química de clic sin cobre, es un problema que impide futuras aplicaciones en campos como el diseño de fármacos o los peptidomiméticos. [25]
Actualmente, la mayoría de los ciclooctinos reaccionan para formar mezclas regioisoméricas. [m] El análisis computacional ha descubierto que, si bien se calcula que la regioselectividad en fase gaseosa favorece la adición 1,5 sobre la adición 1,4 en hasta 2,9 kcal/mol en energía de activación, las correcciones de solvatación dan como resultado las mismas barreras energéticas para ambos regioisómeros. Si bien el isómero 1,4 en la cicloadición de DIFO se ve desfavorecido por su mayor momento dipolar, la solvatación lo estabiliza con más fuerza que el isómero 1,5, lo que erosiona la regioselectividad. [24]
Las ciclooctinas simétricas como BCN (biciclo[6.1.0]nonino) forman un único regioisómero tras la cicloadición [26] y pueden servir para abordar este problema en el futuro.
La aplicación más extendida de la química de clic sin cobre es en la obtención de imágenes biológicas en células vivas o animales utilizando una biomolécula marcada con azida y un ciclooctino que lleva un agente de obtención de imágenes.
Las variantes ceto y oxima fluorescentes de DIBO se utilizan en reacciones de clic de interruptor de flúor en las que la fluorescencia del ciclooctino se extingue por el triazol que se forma en la reacción. [27] Por otro lado, se han desarrollado ciclooctinos conjugados con cumarina, como coumBARAC, de modo que el alquino suprime la fluorescencia mientras que la formación de triazol aumenta el rendimiento cuántico de fluorescencia diez veces. [28]
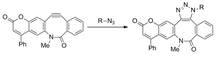
Se ha investigado el control espacial y temporal del etiquetado del sustrato utilizando ciclooctinas fotoactivables. Esto permite equilibrar el alquino antes de la reacción para reducir los artefactos como resultado de los gradientes de concentración. Las ciclooctinas enmascaradas no pueden reaccionar con azidas en la oscuridad, pero se convierten en alquinos reactivos tras la irradiación con luz. [29]
Se está estudiando la química de clic sin cobre para su uso en la síntesis de agentes de imágenes PET que deben producirse rápidamente con alta pureza y rendimiento para minimizar la descomposición isotópica antes de que se puedan administrar los compuestos. Tanto las constantes de velocidad altas como la bioortogonalidad de SPAAC son aptas para la química PET. [30]
La química de clic sin cobre se ha adaptado para utilizar nitronas como dipolo 1,3 en lugar de azidas y se ha utilizado en la modificación de péptidos. [9]
Esta cicloadición entre una nitrona y una ciclooctina forma isoxazolinas N-alquiladas. La velocidad de reacción se mejora con agua y es extremadamente rápida, con constantes de velocidad de segundo orden que van de 12 a 32 M −1 •s −1 , dependiendo de la sustitución de la nitrona. Aunque la reacción es extremadamente rápida, enfrenta problemas para incorporar la nitrona a biomoléculas a través del etiquetado metabólico. El etiquetado solo se ha logrado a través de la modificación postraduccional de péptidos.
Se han desarrollado cicloadiciones dipolares 1,3 como una reacción bioortogonal utilizando un óxido de nitrilo como dipolo 1,3 y un norborneno como dipolarófilo. Su uso principal ha sido en el etiquetado de ADN y ARN en sintetizadores de oligonucleótidos automatizados [31] y en la reticulación de polímeros en presencia de células vivas. [32]
Los norbornenos fueron seleccionados como dipolarófilos debido a su equilibrio entre la reactividad y la estabilidad promovidas por la tensión. Las desventajas de esta reacción incluyen la reactividad cruzada del óxido de nitrilo debido a la fuerte electrofilia y la cinética lenta de la reacción.
La cicloadición de oxanorbornadieno es una cicloadición 1,3-dipolar seguida de una reacción retro - Diels Alder para generar un conjugado unido a triazol con la eliminación de una molécula de furano . [33] El trabajo preliminar ha establecido su utilidad en experimentos de etiquetado de péptidos, y también se ha utilizado en la generación de compuestos de imágenes SPECT . [34] Más recientemente, se describió el uso de un oxanorbornadieno en una reacción "iClick" a temperatura ambiente sin catalizador, en la que un aminoácido modelo está unido a la fracción metálica, en un enfoque novedoso para las reacciones bioortogonales. [35]
La tensión del anillo y la deficiencia de electrones en el oxanorbornadieno aumentan la reactividad hacia el paso limitante de la velocidad de cicloadición. La reacción retro-Diels-Alder ocurre rápidamente después para formar el 1,2,3-triazol estable. Los problemas incluyen una baja tolerancia a los sustituyentes que pueden cambiar la electrónica del oxanorbornadieno y velocidades bajas (constantes de velocidad de segundo orden del orden de 10 −4 ).
La ligación de tetrazina es la reacción de un trans-cicloocteno y una s- tetrazina en una reacción de Diels Alder de demanda inversa seguida de una reacción retro-Diels Alder para eliminar el gas nitrógeno. [36] La reacción es extremadamente rápida con una constante de velocidad de segundo orden de 2000 M −1 –s −1 (en metanol/agua 9:1) lo que permite modificaciones de biomoléculas a concentraciones extremadamente bajas.
Según el trabajo computacional de Bach, la energía de deformación de los Z-ciclooctenos es de 7,0 kcal/mol en comparación con las 12,4 kcal/mol del ciclooctano debido a la pérdida de dos interacciones transanulares. El E-cicloocteno tiene un doble enlace altamente retorcido que da como resultado una energía de deformación de 17,9 kcal/mol. [37] Como tal, el trans-cicloocteno altamente deformado se utiliza como un dienófilo reactivo . El dieno es una 3,6-diaril-s-tetrazina que ha sido sustituida para resistir la reacción inmediata con agua. La reacción procede a través de una cicloadición inicial seguida de una Diels Alder inversa para eliminar N 2 y evitar la reversibilidad de la reacción. [11]
La reacción no sólo es tolerante al agua, sino que se ha descubierto que la velocidad aumenta en medios acuosos. También se han realizado reacciones utilizando norbornenos como dienófilos a velocidades de segundo orden del orden de 1 M −1 •s −1 en medios acuosos. La reacción se ha aplicado en el marcaje de células vivas [38] y en el acoplamiento de polímeros. [39]
Esta reacción de clic de isocianuro es una cicloadición [4+1] seguida de una eliminación retro-Diels Alder de N 2 . [12]
La reacción se lleva a cabo con una cicloadición [4+1] inicial seguida de una reversión para eliminar un descenso termodinámico y evitar la reversibilidad. Este producto es estable si se utiliza una amina terciaria o isocianopropanoato. Si se utiliza un isocianuro secundario o primario, el producto formará una imina que se hidroliza rápidamente.
El isocianuro es un indicador químico preferido debido a su pequeño tamaño, estabilidad, no toxicidad y ausencia en sistemas de mamíferos. Sin embargo, la reacción es lenta, con constantes de velocidad de segundo orden del orden de 10 −2 M −1 •s −1 .
La química del fotoclic utiliza una cicloeliminación fotoinducida para liberar N 2 . Esto genera un intermediario de imina de 1,3 nitrilo de vida corta a través de la pérdida de gas nitrógeno, que sufre una cicloadición 1,3-dipolar con un alqueno para generar cicloaductos de pirazolina. [12]
La fotoinducción se produce con una breve exposición a la luz (la longitud de onda depende del tetrazol) para minimizar el daño causado por la luz a las células. La reacción se potencia en condiciones acuosas y genera un único regioisómero.
La imina de nitrilo transitoria es altamente reactiva para la cicloadición 1,3-dipolar debido a una estructura doblada que reduce la energía de distorsión. La sustitución con grupos donadores de electrones en anillos de fenilo aumenta la energía HOMO, cuando se coloca en la imina de 1,3 nitrilo y aumenta la velocidad de reacción.
Las ventajas de este enfoque incluyen la capacidad de controlar espacial o temporalmente la reacción y la capacidad de incorporar tanto alquenos como tetrazoles en biomoléculas utilizando métodos biológicos simples como la codificación genética. [40] Además, el tetrazol puede diseñarse para que sea fluorogénico con el fin de monitorear el progreso de la reacción. [41]
La ligadura de cuadriciclano utiliza un cuadriciclano altamente deformado para experimentar una cicloadición [2+2+2] con sistemas π. [13]
El cuadriciclano es abiótico, no reacciona con biomoléculas (debido a la saturación completa), es relativamente pequeño y presenta una gran tensión (~80 kcal/mol). Sin embargo, es muy estable a temperatura ambiente y en condiciones acuosas a pH fisiológico. Es selectivamente capaz de reaccionar con sistemas π pobres en electrones, pero no con alquenos, alquinos o ciclooctinos simples.
Se eligió el bis(ditiobencil)níquel(II) como socio de reacción de un análisis de candidatos basado en la reactividad. Para evitar la reversión inducida por la luz a norbornadieno, se agrega dietilditiocarbamato para quelar el níquel en el producto.
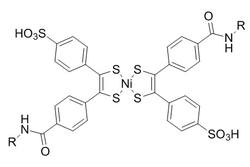
Estas reacciones se mejoran en condiciones acuosas con una constante de velocidad de segundo orden de 0,25 M −1 •s −1 . Es de particular interés que se ha demostrado que es bioortogonal tanto a la formación de oxima como a la química de clic sin cobre.
La química bioortogonal es una herramienta atractiva para experimentos de predisposición en imágenes nucleares y radioterapia . [42]