En química inorgánica , el bicarbonato ( nomenclatura recomendada por la IUPAC : hidrogenocarbonato [2] ) es una forma intermedia en la desprotonación del ácido carbónico . Es un anión poliatómico con la fórmula química HCO−
3.
El bicarbonato cumple una función bioquímica crucial en el sistema de amortiguación del pH fisiológico . [3]
El término "bicarbonato" fue acuñado en 1814 por el químico inglés William Hyde Wollaston . [4] [5] El nombre sigue vivo como un nombre trivial .
El ion bicarbonato (ion hidrogenocarbonato) es un anión con la fórmula empírica HCO−
3y una masa molecular de 61,01 daltons ; consta de un átomo de carbono central rodeado de tres átomos de oxígeno en una disposición plana trigonal , con un átomo de hidrógeno unido a uno de los oxígenos. Es isoelectrónico con el ácido nítrico HNO
3El ion bicarbonato tiene una carga formal negativa y es una especie anfiprótica que tiene propiedades tanto ácidas como básicas. Es a la vez la base conjugada del ácido carbónico H
2CO
3; y el ácido conjugado de CO2−
3, el ion carbonato , como lo muestran estas reacciones de equilibrio :
Una sal de bicarbonato se forma cuando un ion con carga positiva se une a los átomos de oxígeno con carga negativa del ion, formando un compuesto iónico . Muchos bicarbonatos son solubles en agua a temperatura y presión estándar ; en particular, el bicarbonato de sodio contribuye a los sólidos disueltos totales , un parámetro común para evaluar la calidad del agua . [6]
Bicarbonato ( HCO−
3) es un componente vital del sistema de amortiguación del pH [3] del cuerpo humano (manteniendo la homeostasis ácido-base ). Entre el 70% y el 75% del CO 2 del cuerpo se convierte en ácido carbónico (H 2 CO 3 ), que es el ácido conjugado del HCO−
3y puede convertirse rápidamente en ello. [ cita requerida ]
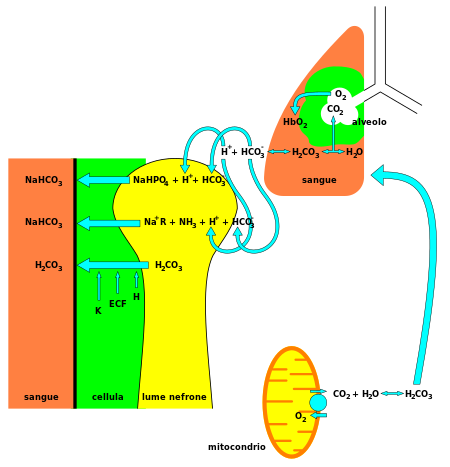
Con el ácido carbónico como especie intermedia central , el bicarbonato –en conjunción con agua, iones de hidrógeno y dióxido de carbono– forma este sistema amortiguador, que se mantiene en el equilibrio volátil [3] necesario para proporcionar una resistencia rápida a los cambios de pH tanto en dirección ácida como básica . Esto es especialmente importante para proteger los tejidos del sistema nervioso central , donde los cambios de pH demasiado fuera del rango normal en cualquier dirección podrían resultar desastrosos (ver acidosis o alcalosis ). Recientemente también se ha demostrado que el metabolismo celular del bicarbonato puede ser regulado por la señalización mTORC1. [7]
Además, el bicarbonato desempeña un papel fundamental en el sistema digestivo. Aumenta el pH interno del estómago, después de que los jugos digestivos altamente ácidos hayan terminado de digerir los alimentos. El bicarbonato también actúa para regular el pH en el intestino delgado. Se libera desde el páncreas en respuesta a la hormona secretina para neutralizar el quimo ácido que ingresa al duodeno desde el estómago. [8]
El bicarbonato es la forma predominante de carbono inorgánico disuelto en el agua de mar [9] y en la mayoría de las aguas dulces. Por ello, es un importante sumidero en el ciclo del carbono .
Algunas plantas como Chara utilizan carbonato y producen carbonato de calcio (CaCO 3 ) como resultado del metabolismo biológico. [10]
En la ecología de agua dulce, la intensa actividad fotosintética de las plantas de agua dulce durante el día libera oxígeno gaseoso en el agua y, al mismo tiempo, produce iones de bicarbonato. Estos aumentan el pH hasta que, en determinadas circunstancias, el grado de alcalinidad puede volverse tóxico para algunos organismos o puede hacer que otros componentes químicos, como el amoníaco, sean tóxicos. En la oscuridad, cuando no se produce la fotosíntesis, los procesos de respiración liberan dióxido de carbono y no se producen nuevos iones de bicarbonato, lo que da lugar a una rápida caída del pH. [ cita requerida ]
El flujo de iones de bicarbonato de las rocas erosionadas por el ácido carbónico del agua de lluvia es una parte importante del ciclo del carbono .
La sal más común del ion bicarbonato es el bicarbonato de sodio , NaHCO3 , que se conoce comúnmente como bicarbonato de sodio . Cuando se calienta o se expone a un ácido como el ácido acético ( vinagre ), el bicarbonato de sodio libera dióxido de carbono . Este se utiliza como agente leudante en la repostería . [ cita requerida ]
El bicarbonato de amonio se utiliza en la fabricación de galletas digestivas . [ cita requerida ]
En medicina diagnóstica , el valor sanguíneo de bicarbonato es uno de los varios indicadores del estado de la fisiología ácido-base en el cuerpo. Se mide, junto con el cloruro , el potasio y el sodio , para evaluar los niveles de electrolitos en una prueba de panel de electrolitos (que tiene el código 80051 de la Terminología de Procedimientos Actuales , CPT). [ cita requerida ]
El parámetro concentración estándar de bicarbonato (SBC e ) es la concentración de bicarbonato en la sangre a una PaCO 2 de 40 mmHg (5,33 kPa), saturación completa de oxígeno y 36 °C. [11]

El indicador más común de la calidad del agua es la concentración de sólidos disueltos totales (TDS).