
En química teórica , un orbital antienlazante es un tipo de orbital molecular que debilita el enlace químico entre dos átomos y ayuda a aumentar la energía de la molécula en relación con los átomos separados. Un orbital de este tipo tiene uno o más nodos en la región de enlace entre los núcleos . La densidad de los electrones en el orbital se concentra fuera de la región de enlace y actúa para alejar un núcleo del otro y tiende a causar repulsión mutua entre los dos átomos. [1] [2] Esto contrasta con un orbital molecular enlazante , que tiene una energía menor que la de los átomos separados y es responsable de los enlaces químicos.
Los orbitales moleculares antienlazantes (OM) normalmente tienen mayor energía que los orbitales moleculares de enlace. Los orbitales de enlace y antienlazantes se forman cuando los átomos se combinan para formar moléculas. [3] Si dos átomos de hidrógeno están inicialmente muy separados, tienen orbitales atómicos idénticos . Sin embargo, a medida que el espaciamiento entre los dos átomos se hace más pequeño, las funciones de onda de los electrones comienzan a superponerse. El principio de exclusión de Pauli prohíbe que dos electrones (e-) en una molécula tengan el mismo conjunto de números cuánticos . [4] Por lo tanto, cada orbital atómico original de los átomos aislados (por ejemplo, el nivel de energía del estado fundamental, 1 s ) se divide en dos orbitales moleculares que pertenecen al par, uno con menor energía que el nivel atómico original y otro con mayor energía. El orbital que está en un estado de energía más bajo que los orbitales de los átomos separados es el orbital de enlace, que es más estable y promueve la unión de los dos átomos de H en H 2 . El orbital de mayor energía es el orbital antienlazante, que es menos estable y se opone al enlace si está ocupado. En una molécula como el H 2 , los dos electrones normalmente ocupan el orbital de enlace de menor energía, de modo que la molécula es más estable que los átomos de H por separado.
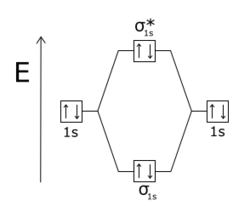
Un orbital molecular se vuelve antienlazante cuando hay menos densidad electrónica entre los dos núcleos de la que habría si no hubiera interacción de enlace en absoluto. [5] Cuando un orbital molecular cambia de signo (de positivo a negativo) en un plano nodal entre dos átomos, se dice que es antienlazante con respecto a esos átomos . Los orbitales antienlazantes suelen estar etiquetados con un asterisco (*) en los diagramas de orbitales moleculares.
En las moléculas diatómicas homonucleares , los orbitales antienlazantes σ* ( estrella sigma ) no tienen planos nodales que pasen por los dos núcleos, como los enlaces sigma , y los orbitales π* ( estrella pi ) tienen un plano nodal que pasa por los dos núcleos, como los enlaces pi . El principio de exclusión de Pauli dicta que no puede haber dos electrones en un sistema en interacción que tengan el mismo estado cuántico. Si los orbitales de enlace están llenos, entonces cualquier electrón adicional ocupará orbitales antienlazantes. Esto ocurre en la molécula He 2 , en la que están llenos tanto los orbitales 1sσ como los 1sσ*. [6] Dado que el orbital antienlazante es más antienlazante que el orbital de enlace , la molécula tiene una energía más alta que dos átomos de helio separados y, por lo tanto, es inestable.

En las moléculas con varios átomos, algunos orbitales pueden estar deslocalizados en más de dos átomos. Un orbital molecular particular puede ser enlazante con respecto a algunos pares adyacentes de átomos y antienlazante con respecto a otros pares . Si las interacciones de enlace superan en número a las interacciones antienlazantes, se dice que el OM es enlazante , mientras que, si las interacciones antienlazantes superan en número a las interacciones de enlace, se dice que el orbital molecular es antienlazante .
Por ejemplo, el butadieno tiene orbitales pi que están deslocalizados sobre los cuatro átomos de carbono. Hay dos orbitales pi de enlace que están ocupados en el estado fundamental : π 1 es de enlace entre todos los carbonos, mientras que π 2 es de enlace entre C 1 y C 2 y entre C 3 y C 4 , y antienlazante entre C 2 y C 3 . También hay orbitales pi antienlazantes con dos y tres interacciones antienlazantes como se muestra en el diagrama; estos están vacantes en el estado fundamental , pero pueden estar ocupados en estados excitados .
De manera similar, el benceno, con seis átomos de carbono, tiene tres orbitales pi enlazantes y tres orbitales pi antienlazantes. Como cada átomo de carbono aporta un electrón al sistema π del benceno, hay seis electrones pi que llenan los tres orbitales moleculares pi de menor energía (los orbitales pi enlazantes).
Los orbitales antienlazantes también son importantes para explicar las reacciones químicas en términos de la teoría de orbitales moleculares. Roald Hoffmann y Kenichi Fukui compartieron el Premio Nobel de Química de 1981 por su trabajo y el desarrollo de explicaciones cualitativas de los orbitales moleculares para las reacciones químicas. [7]