La antiaromaticidad es una propiedad química de una molécula cíclica con un sistema de electrones π que tiene mayor energía, es decir, es menos estable debido a la presencia de 4n electrones deslocalizados (π o par solitario) en ella, a diferencia de la aromaticidad . A diferencia de los compuestos aromáticos , que siguen la regla de Hückel ([4 n +2] electrones π) [1] y son altamente estables, los compuestos antiaromáticos son altamente inestables y altamente reactivos. Para evitar la inestabilidad de la antiaromaticidad, las moléculas pueden cambiar de forma, volviéndose no planas y, por lo tanto, rompiendo algunas de las interacciones π. A diferencia de la corriente de anillo diamagnético presente en los compuestos aromáticos , los compuestos antiaromáticos tienen una corriente de anillo paramagnético, que se puede observar mediante espectroscopia de RMN.

Ejemplos de compuestos antiaromáticos son el pentaleno (A), el bifenileno (B) y el catión ciclopentadienilo (C). El ejemplo prototípico de antiaromaticidad, el ciclobutadieno , es objeto de debate, y algunos científicos sostienen que la antiaromaticidad no es un factor importante que contribuya a su desestabilización. [2]
El ciclooctatetraeno es un ejemplo de una molécula que adopta una geometría no plana para evitar la desestabilización que resulta de la antiaromaticidad. Si fuera plana, tendría un único sistema π de ocho electrones alrededor del anillo, pero en cambio adopta una forma similar a la de un barco con cuatro enlaces π individuales. [3] Debido a que los compuestos antiaromáticos suelen tener una vida útil corta y es difícil trabajar con ellos experimentalmente, la energía de desestabilización antiaromática a menudo se modela mediante simulación en lugar de mediante experimentación. [2]
El término "antiaromaticidad" fue propuesto por primera vez por Ronald Breslow en 1967 como "una situación en la que una deslocalización cíclica de electrones es desestabilizadora". [4] Los criterios de la IUPAC para la antiaromaticidad son los siguientes: [5]
Esto difiere de la aromaticidad solo en el cuarto criterio: las moléculas aromáticas tienen 4 n +2 electrones π en el sistema π conjugado y, por lo tanto, siguen la regla de Hückel . Las moléculas no aromáticas son no cíclicas, no planares o no tienen un sistema π conjugado completo dentro del anillo.
Tener un sistema de anillos planos es esencial para maximizar la superposición entre los orbitales p que forman el sistema π conjugado. Esto explica por qué ser una molécula plana y cíclica es una característica clave tanto de las moléculas aromáticas como de las antiaromáticas. Sin embargo, en realidad, es difícil determinar si una molécula está o no completamente conjugada simplemente observando su estructura: a veces las moléculas pueden distorsionarse para aliviar la tensión y esta distorsión tiene el potencial de interrumpir la conjugación. Por lo tanto, se deben realizar esfuerzos adicionales para determinar si una determinada molécula es o no genuinamente antiaromática. [6]
Un compuesto antiaromático puede demostrar su antiaromaticidad tanto cinética como termodinámicamente. Como se discutirá más adelante, los compuestos antiaromáticos experimentan una reactividad química excepcionalmente alta (ser altamente reactivo no es “indicativo” de un compuesto antiaromático, simplemente sugiere que el compuesto podría ser antiaromático). Un compuesto antiaromático también puede reconocerse termodinámicamente midiendo la energía del sistema de electrones π conjugados cíclicos. En un compuesto antiaromático, la cantidad de energía de conjugación en la molécula será significativamente mayor que en un compuesto de referencia apropiado. [7]
En realidad, se recomienda que se analice en profundidad la estructura de un compuesto potencialmente antiaromático antes de declarar que es efectivamente antiaromático. Si no existe una estructura determinada experimentalmente de la molécula en cuestión, se debe realizar un análisis computacional. Se debe investigar la energía potencial de la molécula en diversas geometrías para evaluar cualquier distorsión de una conformación plana simétrica. [6] Se recomienda este procedimiento porque ha habido múltiples casos en el pasado en los que moléculas que parecen ser antiaromáticas en el papel resultan no serlo en la realidad. La más famosa (y muy debatida) de estas moléculas es el ciclobutadieno, como se analiza más adelante.
Ejemplos de compuestos antiaromáticos son pentaleno (A), bifenileno (B), catión ciclopentadienilo (C). El ejemplo prototípico de antiaromaticidad, el ciclobutadieno , es objeto de debate, y algunos científicos sostienen que la antiaromaticidad no es un factor importante que contribuya a su desestabilización. [2] El ciclooctatetraeno parece a primera vista ser antiaromático, pero es un excelente ejemplo de una molécula que adopta una geometría no plana para evitar la desestabilización que resulta de la antiaromaticidad. [3] Debido a que los compuestos antiaromáticos suelen tener una vida útil corta y es difícil trabajar con ellos experimentalmente, la energía de desestabilización antiaromática a menudo se modela mediante simulación en lugar de mediante experimentación. [2]
La corriente paramagnética del anillo resultante de la deslocalización de electrones en compuestos antiaromáticos se puede observar por RMN . Esta corriente de anillo conduce a un desprotección (desplazamiento hacia abajo del campo) de los núcleos dentro del anillo y un apantallamiento (desplazamiento hacia arriba del campo) de los núcleos fuera del anillo. [12] El anuleno es un hidrocarburo antiaromático que es lo suficientemente grande como para tener protones tanto dentro como fuera del anillo. El desplazamiento químico para los protones fuera de su anillo es de 5,91 ppm y el de los protones dentro del anillo es de 7,86 ppm, en comparación con el rango normal de 4,5-6,5 ppm para los alquenos no aromáticos. Este efecto es de una magnitud menor que los desplazamientos correspondientes en compuestos aromáticos. [8]
Muchos compuestos aromáticos y antiaromáticos (benceno y ciclobutadieno) son demasiado pequeños para tener protones dentro del anillo, donde los efectos de apantallamiento y desprotección pueden ser más útiles para el diagnóstico a la hora de determinar si un compuesto es aromático, antiaromático o no aromático. El análisis del desplazamiento químico independiente del núcleo (NICS) es un método para calcular el apantallamiento (o desprotección) del anillo en el centro de un sistema de anillos para predecir la aromaticidad o la antiaromaticidad. Un valor NICS negativo es indicativo de aromaticidad y un valor positivo es indicativo de antiaromaticidad. [9]
Si bien existen multitud de moléculas que parecen antiaromáticas en teoría, la cantidad de moléculas que lo son en realidad es considerablemente menor. Esto se ve agravado por el hecho de que, por lo general, no es posible obtener derivados de moléculas antiaromáticas añadiendo más anillos de hidrocarburos antiaromáticos, etc., porque la molécula normalmente pierde su naturaleza plana o su sistema conjugado de electrones π y se vuelve no aromática. [10] En esta sección, solo se incluyen ejemplos de compuestos antiaromáticos que no son discutibles.
El pentaleno es un compuesto antiaromático que ha sido bien estudiado tanto experimental como computacionalmente durante décadas. Es dicíclico, plano y tiene ocho electrones π, lo que cumple con la definición de antiaromaticidad de la IUPAC. Los estados dianiónico y dicatiónico del pentaleno son aromáticos, ya que siguen la regla de los 4 n +2 electrones π de Hückel. [11]

Al igual que su pariente [12]anuleno , el hexadehidro-[12]anuleno también es antiaromático. Su estructura se ha estudiado computacionalmente mediante cálculos de teoría funcional de la densidad y ab initio y se ha confirmado que es antiaromático. [12]
El ciclobutadieno es un ejemplo clásico de un compuesto antiaromático. Se entiende convencionalmente que es plano, cíclico y tiene 4 electrones π (4 n para n = 1) en un sistema conjugado.

Sin embargo, durante mucho tiempo se ha cuestionado si el ciclobutadieno es genuinamente antiaromático y descubrimientos recientes han sugerido que puede no serlo. El ciclobutadieno es particularmente desestabilizado y esto se atribuyó originalmente a la antiaromaticidad. Sin embargo, el ciclobutadieno adopta más carácter de doble enlace en dos de sus enlaces paralelos que otros y los electrones π no están deslocalizados entre los dos enlaces tipo doble enlace, lo que le da una forma rectangular en lugar de un cuadrado regular. [3] Como tal, el ciclobutadieno se comporta como dos alquenos discretos unidos por dos enlaces simples y, por lo tanto, es no aromático en lugar de antiaromático.
A pesar de la falta de este efecto de desestabilización antiaromático π, ninguno de sus parientes con electrones π 4 n (ciclooctatetraeno, etc.) tuvo ni de lejos tanta desestabilización, lo que sugiere que había algo más en juego en el caso del ciclobutadieno. Se descubrió que una combinación de deformación angular , deformación torsional y repulsión de Pauli conduce a la desestabilización extrema experimentada en esta molécula. [2]
Este descubrimiento es extraño porque contradice las enseñanzas básicas de la antiaromaticidad. En este momento, se supone que el ciclobutadieno seguirá utilizándose para introducir el concepto de antiaromaticidad en los libros de texto por conveniencia, aunque clasificarlo como antiaromático desde el punto de vista técnico puede no ser exacto.
El catión ciclopentadienilo es otro ejemplo clásico de compuesto antiaromático. Se entiende convencionalmente que es plano, cíclico y tiene 4 electrones π (4 n para n = 1) en un sistema conjugado.
Sin embargo, durante mucho tiempo se ha cuestionado si el catión ciclopentadienilo es realmente antiaromático y descubrimientos recientes han sugerido que puede que no lo sea. El estado singlete de menor energía es antiaromático, pero el estado triplete de menor energía es aromático debido a la regla de Baird , y la investigación en 2007 mostró que el estado triplete es el estado fundamental . [13]

El ciclooctatetraeno es otro ejemplo de una molécula que no es antiaromática, aunque inicialmente pueda parecerlo. El ciclooctatetraeno asume una conformación de tina (es decir, similar a una barca). Como no es plana, aunque tiene 4 n electrones π, estos electrones no están deslocalizados ni conjugados. Por lo tanto, la molécula no es aromática. [3]
Los compuestos antiaromáticos, que suelen ser muy inestables, pueden ser muy reactivos para aliviar la desestabilización antiaromática. El ciclobutadieno, por ejemplo, se dimeriza rápidamente sin barrera de energía potencial a través de una reacción de cicloadición 2 + 2 para formar triciclooctadieno. [14] Si bien el carácter antiaromático del ciclobutadieno es tema de debate, el alivio de la antiaromaticidad se invoca generalmente como la fuerza impulsora de esta reacción.

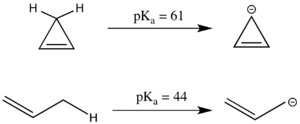
La antiaromaticidad también puede tener un efecto significativo en p K a . El compuesto lineal propeno tiene un p K a de 44, que es relativamente ácido para un centro de carbono sp 3 porque el anión alilo resultante puede estabilizarse por resonancia. El sistema cíclico análogo parece tener incluso más resonancia estabilizada, ya que la carga negativa puede deslocalizarse a través de tres carbonos en lugar de dos. Sin embargo, el anión ciclopropenilo tiene 4 electrones π en un sistema cíclico y de hecho tiene un p K a sustancialmente más alto que el 1-propeno porque es antiaromático y, por lo tanto, desestabilizado. [3] Debido a que los compuestos antiaromáticos a menudo tienen una vida corta y es difícil trabajar con ellos experimentalmente, la energía de desestabilización antiaromática a menudo se modela mediante simulación en lugar de mediante experimentación. [2]
Algunos compuestos antiaromáticos son estables, especialmente los sistemas cíclicos más grandes (en los que la desestabilización antiaromática no es tan sustancial). Por ejemplo, la especie aromática 1 se puede reducir a 2 con una penalización relativamente pequeña por formar un sistema antiaromático. El antiaromático 2 se revierte a la especie aromática 1 con el tiempo al reaccionar con el oxígeno del aire porque se prefiere la aromaticidad. [15]

La pérdida de antiaromaticidad puede ser a veces la fuerza impulsora de una reacción. En la siguiente tautomerización ceto-enólica, el enol resultante es más estable que la cetona original, aunque la cetona contiene una fracción bencánica aromática (azul). Sin embargo, también hay una fracción lactona antiaromática (verde). El alivio de la desestabilización antiaromática proporciona una fuerza impulsora que supera incluso la pérdida de un benceno aromático. [16]
