En química organometálica , la interacción agóstica se refiere a la interacción intramolecular de un metal de transición insaturado coordinativamente con un enlace C−H situado apropiadamente en uno de sus ligandos. La interacción es el resultado de dos electrones involucrados en la interacción del enlace C−H con un orbital d vacío del metal de transición, lo que resulta en un enlace de dos electrones de tres centros . [1] Es un caso especial de un complejo sigma C–H . Históricamente, los complejos agósticos fueron los primeros ejemplos de complejos sigma C–H que se observaron espectroscópicamente y cristalográficamente, debido a que las interacciones intramoleculares eran particularmente favorables y con mayor frecuencia conducían a complejos robustos. Se propone que muchas transformaciones catalíticas que involucran adición oxidativa y eliminación reductora proceden a través de intermediarios que presentan interacciones agósticas. Las interacciones agósticas se observan en toda la química organometálica en ligandos de alquilo , alquilideno y polienilo.
El término agóstico, derivado de la palabra griega antigua que significa "aferrarse a uno mismo", fue acuñado por Maurice Brookhart y Malcolm Green , por sugerencia del clasicista Jasper Griffin , para describir esta y muchas otras interacciones entre un metal de transición y un enlace C−H . A menudo, estas interacciones agósticas involucran grupos alquilo o arilo que se mantienen cerca del centro del metal a través de un enlace σ adicional. [2] [3]
Desde la década de 1960 se han observado interacciones cortas entre sustituyentes de hidrocarburos y complejos metálicos insaturados coordinativamente. Por ejemplo, en el dicloruro de tris( trifenilfosfina ) rutenio, se observa una interacción corta entre el centro de rutenio (II) y un átomo de hidrógeno en la posición orto de uno de los nueve anillos de fenilo. [4] Los complejos de borohidruro se describen utilizando el modelo de enlace de dos electrones de tres centros .
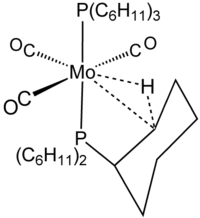
La naturaleza de la interacción fue prefigurada en la química del grupo principal en la química estructural del trimetilaluminio .
Las interacciones agósticas se demuestran mejor mediante cristalografía . Los datos de difracción de neutrones han demostrado que las distancias de enlace C−H y M┄H son entre un 5 y un 20 % más largas de lo esperado para hidruros metálicos e hidrocarburos aislados. La distancia entre el metal y el hidrógeno es típicamente de 1,8 a 2,3 Å y el ángulo M┄H−C está en el rango de 90° a 140°. La presencia de una señal de RMN de 1 H que se desplaza campo arriba de la de un arilo o alcano normal, a menudo a la región normalmente asignada a los ligandos de hidruro . La constante de acoplamiento 1 J CH se reduce típicamente a 70–100 Hz frente a los 125 Hz esperados para un enlace carbono-hidrógeno sp 3 normal.

Sobre la base de estudios experimentales y computacionales , se estima que la estabilización que surge de una interacción agóstica es de 10–15 kcal/mol. Cálculos recientes que utilizan constantes de compliancia apuntan a una estabilización más débil (<10 kcal/mol). [6] Por lo tanto, las interacciones agósticas son más fuertes que la mayoría de los enlaces de hidrógeno . Los enlaces agósticos a veces juegan un papel en la catálisis al aumentar la "rigidez" en los estados de transición. Por ejemplo, en la catálisis de Ziegler-Natta, el centro metálico altamente electrofílico tiene interacciones agósticas con la cadena de polímero en crecimiento. Esta mayor rigidez influye en la estereoselectividad del proceso de polimerización.

El término agóstico se reserva para describir interacciones de enlace de dos electrones y tres centros entre carbono, hidrógeno y un metal. El enlace de dos electrones y tres centros está claramente implicado en la complexación de H 2 , por ejemplo, en W(CO) 3 (PCy 3 ) 2 H 2 , que está estrechamente relacionado con el complejo agóstico que se muestra en la figura. [8] El silano se une a los centros metálicos a menudo a través de interacciones Si┄H−M de tres centros similares a las agósticas. Sin embargo, debido a que estas interacciones no incluyen carbono, no se clasifican como agósticas.
Ciertas interacciones M┄H−C no se clasifican como agósticas, sino que se describen con el término anagósticas . Las interacciones anagósticas tienen un carácter más electrostático. En términos de estructuras de interacciones anagósticas, las distancias M┄H y los ángulos M┄H−C se encuentran en los rangos de 2,3 a 2,9 Å y 110° a 170°, respectivamente. [2] [9]
Las interacciones agósticas cumplen una función clave en la polimerización y estereoquímica de alquenos , así como en la inserción migratoria .