El acoplamiento oxidativo de fenoles es una reacción química en la que dos compuestos fenólicos se acoplan a través de un proceso oxidativo . Los acoplamientos oxidativos de fenoles suelen estar catalizados por complejos de metales de transición, incluidos V , Cr , Mn , Cu y Fe , entre otros. Estas reacciones suelen formar enlaces C–C o C–O entre los socios de acoplamiento y pueden emplearse como acoplamientos homo o cruzados . [1]
Un ejemplo representativo es la reacción del fenol con una solución de tetracloruro de vanadio , que produce un rendimiento de alrededor del 60 % de tres compuestos isoméricos de dihidroxibifenilo. La relación de isómeros y los rendimientos no se ven afectados por la relación reactivo/sustrato. Se sabe que el tetracloruro de vanadio produce oxidaciones de un electrón, lo que se produce en esta conversión. [2]

Los acoplamientos oxidativos de fenol pueden ocurrir a través de procesos de esfera interna o de esfera externa . En los procesos de esfera interna, el sustrato fenólico se coordina con el centro metálico para formar un complejo de fenóxido. La oxidación al fenóxido ocurre a través de transferencia de electrones o abstracción de átomos de hidrógeno. El intermedio reactivo resultante puede participar en procesos químicos posteriores que pueden ocurrir a través de socios de acoplamiento coordinados (esfera interna) o no coordinados.

Las reacciones entre radicales son fáciles de imaginar, pero poco probables, ya que requieren la coexistencia de dos radicales de larga duración. En cambio, el radical fenol o fenoxi se suma a otro fenol o fenóxido. El proceso inicial de formación del enlace CC es seguido por la abstracción del átomo de hidrógeno y la tautomerización.
Los acoplamientos en los que no intervienen catalizadores metálicos generalmente se realizan a través del mecanismo radical-fenol. [3] [4] [5]
Aunque se conocen ejemplos selectos de homoacoplamientos asimétricos, son notoriamente difíciles de diseñar y a menudo se llega a ellos de manera empírica.
Los acoplamientos oxidativos asimétricos enantioselectivos de fenol aún no están bien establecidos ni son generales, sin embargo existen informes que aprovechan catalizadores asimétricos de vanadio para homoacoplar fenoles enantioselectivamente. Por el contrario, se ha avanzado mucho en los acoplamientos asimétricos de 2-naftol utilizando catalizadores de Ru , Cu, V y Fe, [6] que han tenido un gran impacto en el desarrollo de ligandos de tipo BINAP utilizados en catálisis asimétrica.
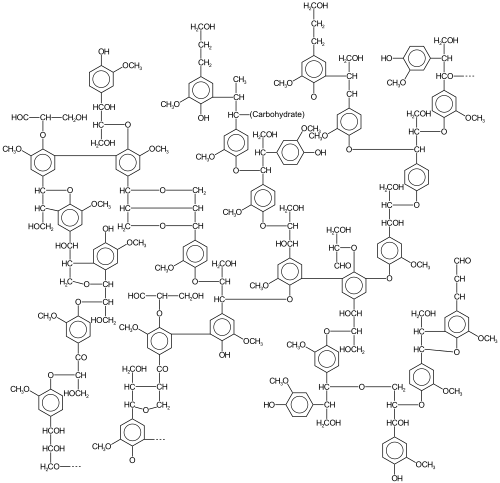
La lignina , un polifenol que se encuentra en la mayoría de las plantas, es una forma muy abundante de biomasa que surge, en parte, por acoplamiento oxidativo de fenoles. Las ligninas son particularmente importantes en la formación de las paredes celulares , especialmente en la madera y la corteza , porque le otorgan rigidez y no se pudren fácilmente. Químicamente, las ligninas son polímeros formados por la reticulación de precursores fenólicos . [7]

El primer ejemplo de acoplamiento oxidativo de fenol en la química sintética se remonta a la síntesis de ácido elágico de Julius Löwe en 1868, realizada calentando ácido gálico con ácido arsénico. [8]
En la síntesis de compuestos orgánicos complejos , a veces se emplean acoplamientos oxidativos de fenol. La reacción es atractiva por su economía de átomos porque evita los materiales de partida prefuncionalizados que a menudo se requieren en los acoplamientos cruzados redox-neutrales tradicionales. Sin embargo, los acoplamientos oxidativos de fenol a menudo sufren de sobreoxidación, especialmente porque el producto acoplado previsto es más oxidable (tiene un potencial de oxidación menor) que el material de partida. En tales casos, el catalizador puede extinguirse o envenenarse al participar en procesos redox fuera de ciclo con el producto. Además, el producto puede oxidarse aún más, dando lugar a oligómeros de orden superior .
Pueden surgir problemas de selectividad durante los acoplamientos oxidativos de fenol entre productos acoplados C–C y C–O. [9] Además, la estereoselectividad es una consideración importante si el compuesto de bifenol resultante muestra quiralidad axial o atropoisomerismo . Se debe considerar la selectividad entre productos homo y heteroacoplados, y a menudo se puede abordar mediante catálisis con metales de transición.

Los acoplamientos oxidativos intramoleculares de fenol se conocen desde hace mucho tiempo. Los ejemplos mejor estudiados de tales transformaciones son aquellos que dan lugar a productos acoplados de fenol-dienona espirocíclicos. Los socios de acoplamiento en un acoplamiento intramolecular deben aproximarse en una disposición casi paralela para permitir la superposición orbital; [10] estas estrictas restricciones geométricas sobre los compuestos preciclados a menudo hacen que el proceso sea lento, si es posible. [11]

Las lacasas a menudo efectúan acoplamientos oxidativos, a veces formando enlaces CO. [12]
El acoplamiento selectivo de C–O de fenoles está representado por unos pocos ejemplos en la química sintética. [13] En muchos casos, el acoplamiento selectivo de C–O solo se puede lograr si se bloquean todas las posiciones orto y para en el areno. [14] La baja selectividad del acoplamiento de C–O probablemente se deba a la falta de densidad de espín radical en el oxígeno después de la oxidación del fenol, lo que resulta en un atrapamiento cinético de los productos de acoplamiento de C–C.
También se han estudiado los acoplamientos oxidativos entre fenoles y compuestos no fenólicos, incluidas anilinas, beta-cetoésteres/malonatos/malononitrilos, arenos ricos en electrones, olefinas y otros grupos funcionales. [1]