El modelo del pudín de pasas fue el primer modelo científico del átomo que describía una estructura interna. Fue propuesto por primera vez por JJ Thomson en 1904 tras su descubrimiento del electrón en 1897, y quedó obsoleto con el descubrimiento del núcleo atómico por Ernest Rutherford en 1911. El modelo intentaba explicar dos propiedades de los átomos que se conocían entonces: que hay electrones y que los átomos no tienen carga eléctrica neta. Lógicamente tenía que haber una cantidad igual de carga positiva para equilibrar la carga negativa de los electrones. Como Thomson no tenía idea de la fuente de esta carga positiva, propuso tentativamente que estaba en todas partes en el átomo y que el átomo era esférico: esta era la hipótesis matemáticamente más simple que se ajustaba a la evidencia disponible, o la falta de ella. En una esfera así, los electrones cargados negativamente se distribuirían de una manera más o menos uniforme por todo el volumen, repelerse entre sí simultáneamente mientras eran atraídos por el centro de la esfera positiva. [1]
Thomson intentó sin éxito desarrollar un modelo completo que pudiera predecir otras propiedades conocidas del átomo, como los espectros de emisión y las valencias . Basándose en estudios experimentales de dispersión de partículas alfa , Ernest Rutherford desarrolló un modelo alternativo para el átomo que presenta un núcleo compacto donde se concentra la carga positiva.
El modelo de Thomson se conoce popularmente como el "modelo del pudín de pasas", con la idea de que los electrones están distribuidos uniformemente como las pasas en un pudín de pasas . Ni Thomson ni sus colegas utilizaron nunca esta analogía. [2] Parece haber sido acuñada por escritores de divulgación científica para que el modelo fuera más fácil de entender para el profano. La analogía es quizás engañosa porque Thomson comparó la esfera positiva con un líquido en lugar de un sólido, ya que pensaba que los electrones se movían en ella. [3]
El modelo de Thomson marca el momento en que el desarrollo de la teoría atómica pasó de los químicos a los físicos. Si bien la teoría atómica había sido ampliamente aceptada por los químicos a fines del siglo XIX, los físicos seguían siendo escépticos porque el modelo atómico carecía de propiedades que concernieran a su campo, como la carga eléctrica , el momento magnético , el volumen o la masa absoluta. Antes del modelo de Thomson, los átomos eran simplemente las unidades básicas de peso por las que reaccionan los elementos químicos. El propio Thomson era físico y su modelo atómico fue un subproducto de sus investigaciones sobre los rayos catódicos , mediante los cuales descubrió las partículas con carga negativa que ahora se conocen como electrones . Thomson planteó la hipótesis de que la cantidad, la disposición y los movimientos de los electrones en el átomo podrían explicar sus propiedades físicas y químicas, como los espectros de emisión, las valencias, la reactividad y la ionización. Estaba en el camino correcto, aunque su enfoque se basaba en la mecánica clásica y no tenía la perspicacia para incorporarle energía cuantizada.
A lo largo del siglo XIX, se fueron acumulando pruebas de la química y la mecánica estadística de que la materia estaba compuesta de átomos. Se discutió la estructura del átomo y, a finales de siglo, el modelo principal [4] :175 era la teoría de los vórtices del átomo , propuesta por William Thomson (más tarde Lord Kelvin) en 1867. [5] En 1890, JJ Thomson tenía su propia versión llamada la hipótesis del "átomo nebular", en la que los átomos estaban compuestos de vórtices inmateriales y sugería similitudes entre la disposición de los vórtices y la regularidad periódica encontrada entre los elementos químicos. [6]
El descubrimiento del electrón por parte de Thomson en 1897 cambió sus puntos de vista. Thomson los llamó "corpúsculos" ( partículas ), pero más comúnmente se los llamaba "electrones", el nombre que G. J. Stoney había acuñado para la " unidad fundamental de la electricidad " en 1891. [7] Sin embargo, incluso a fines de 1899, pocos científicos creían en las partículas subatómicas. [8] : I:365
Otro tema científico emergente del siglo XIX fue el descubrimiento y estudio de la radiactividad . Thomson descubrió el electrón estudiando los rayos catódicos , y en 1900 Henri Becquerel determinó que la radiación del uranio, ahora llamadas partículas beta , tenía la misma relación carga/masa que los rayos catódicos. [8] : II:3 Se creía que estas partículas beta eran electrones que viajaban a alta velocidad. Las partículas fueron utilizadas por Thomson para sondear los átomos y encontrar evidencia de su teoría atómica. La otra forma de radiación crítica para esta era de modelos atómicos fueron las partículas alfa . Más pesadas y lentas que las partículas beta, estas fueron la herramienta clave utilizada por Rutherford para encontrar evidencia en contra del modelo de Thomson.
Además de la teoría atómica emergente, el electrón y la radiación, el último elemento de la historia fueron los numerosos estudios de espectros atómicos publicados a finales del siglo XIX. Parte del atractivo del modelo de vórtice era su posible papel en la descripción de los datos espectrales como respuestas vibracionales a la radiación electromagnética. [4] : 177 Ni el modelo de Thomson ni su sucesor, el modelo de Rutherford, avanzaron en la comprensión de los espectros atómicos. Eso tendría que esperar hasta que Niels Bohr construyera el primer modelo atómico basado en la cuántica.
El modelo de Thomson fue el primero en asignar una estructura interna específica a un átomo, [9] : 9 aunque sus primeras descripciones no incluían fórmulas matemáticas. [2] Desde 1897 hasta 1913, Thomson propuso una serie de modelos polielectrónicos cada vez más detallados para el átomo. [4] : 178 Sus primeras versiones fueron cualitativas y culminaron en su artículo de 1906 y los resúmenes posteriores. El modelo de Thomson cambió a lo largo de su publicación inicial, y finalmente se convirtió en un modelo con mucha más movilidad que contenía electrones que giraban en el campo denso de carga positiva en lugar de una estructura estática. Thomson intentó sin éxito reformular su modelo para tener en cuenta algunas de las principales líneas espectrales conocidas experimentalmente para varios elementos. [10]
En un artículo titulado Cathode Rays (Rayos catódicos) , [11] Thomson demostró que los rayos catódicos no son luz, sino que están hechos de partículas con carga negativa a las que llamó corpúsculos . Observó que los rayos catódicos pueden ser desviados por campos eléctricos y magnéticos, lo que no sucede con los rayos de luz. En unos pocos párrafos cerca del final de este largo artículo, Thomson analiza la posibilidad de que los átomos estuvieran hechos de estos corpúsculos , llamándolos átomos primordiales . Thomson creía que el intenso campo eléctrico alrededor del cátodo causaba que las moléculas de gas circundantes se dividieran en sus corpúsculos componentes , generando así rayos catódicos. Thomson mostró así evidencia de que los átomos eran divisibles, aunque no intentó describir su estructura en este punto.
Thomson señala que no fue el primer científico en proponer que los átomos son divisibles, haciendo referencia a William Prout , quien en 1815 descubrió que los pesos atómicos de varios elementos eran múltiplos del peso atómico del hidrógeno y planteó la hipótesis de que todos los átomos estaban formados por átomos de hidrógeno fusionados. [9] La hipótesis de Prout fue descartada por los químicos cuando en la década de 1830 se descubrió que algunos elementos parecían tener un peso atómico no entero (por ejemplo, el cloro tiene un peso atómico de aproximadamente 35,45). Pero el concepto siguió teniendo influencia. Las discrepancias se explicaron finalmente con el descubrimiento de los isótopos en 1912.
Unos meses después de que apareciera el artículo de Thomson, George FitzGerald sugirió que el corpúsculo identificado por Thomson a partir de rayos catódicos y propuesto como partes de un átomo era un "electrón libre", como lo describieron el físico Joseph Larmor y Hendrik Lorentz . Si bien Thomson no adoptó la terminología, la conexión convenció a otros científicos de que los rayos catódicos eran partículas, un paso importante en su aceptación final de un modelo atómico basado en partículas subatómicas. [12]
En 1899, Thomson reiteró su modelo atómico en un artículo que mostraba que la electricidad negativa creada por la luz ultravioleta que incide sobre un metal (ahora conocida como efecto fotoeléctrico ) tiene la misma relación masa-carga que los rayos catódicos; luego aplicó su método anterior para determinar la carga de los iones a las partículas eléctricas negativas creadas por la luz ultravioleta. [4] : 86 Estimó que la masa del electrón era 0,0014 veces la del ion hidrógeno (como fracción: 1/714 ). [13] En la conclusión de este artículo escribe: [9]
Considero que el átomo contiene una gran cantidad de cuerpos más pequeños que llamaré corpúsculos; estos corpúsculos son iguales entre sí; la masa de un corpúsculo es la masa del ion negativo en un gas a baja presión, es decir, aproximadamente 3 × 10 -26 de un gramo. En el átomo normal, este conjunto de corpúsculos forma un sistema que es eléctricamente neutro. El efecto negativo se equilibra con algo que hace que el espacio a través del cual se extienden los corpúsculos actúe como si tuviera una carga de electricidad positiva igual en cantidad a la suma de las cargas negativas en los corpúsculos.
Thomson proporcionó su primera descripción detallada del átomo en su artículo de 1904 Sobre la estructura del átomo . [14] Thomson comienza con una breve descripción de su modelo .
... los átomos de los elementos están constituidos por un número de corpúsculos electrificados negativamente encerrados en una esfera de electrificación positiva uniforme, ... [14]
Centrado principalmente en los electrones, Thomson adoptó la esfera positiva del modelo atómico de Kelvin propuesto un año antes. [10] [15] A continuación, ofrece un análisis mecánico detallado de dicho sistema, distribuyendo los electrones de manera uniforme alrededor de un anillo. La atracción de la electrificación positiva se equilibra con la repulsión mutua de los electrones. Su análisis se centra en la estabilidad, buscando casos en los que pequeños cambios de posición se contrarresten con fuerzas restauradoras.
Después de analizar sus numerosas fórmulas para la estabilidad, se dedicó a analizar patrones en el número de electrones en varios anillos concéntricos de configuraciones estables. Thomson argumentó que estos patrones regulares son análogos a la ley periódica de la química que subyace a la estructura de la tabla periódica . Este concepto, de que un modelo basado en partículas subatómicas podría explicar las tendencias químicas, alentó el interés en el modelo de Thomson e influyó en trabajos futuros, incluso si los detalles de las asignaciones de electrones de Thomson resultaron ser incorrectos. [16] : 135
Thomson en este punto creía que toda la masa del átomo era transportada por los electrones. [17] Esto significaría que incluso un átomo pequeño tendría que contener miles de electrones, y la electrificación positiva que los encapsulaba no tenía masa. [18]
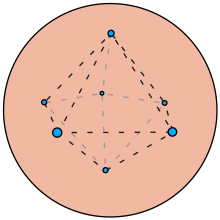
En una conferencia pronunciada en la Royal Institution of Great Britain en 1905, [19] Thomson explicó que era demasiado difícil desde el punto de vista computacional para él calcular los movimientos de un gran número de electrones en la esfera positiva, por lo que propuso un experimento práctico. Este consistía en introducir alfileres magnetizados en discos de corcho y dejarlos flotando en un recipiente con agua. Los alfileres estaban orientados de tal manera que se repelían entre sí. Sobre el centro del recipiente había suspendido un electroimán que atraía a los alfileres. La disposición de equilibrio que adoptaban los alfileres informó a Thomson sobre las disposiciones que podían adoptar los electrones en un átomo, aunque la información era limitada, ya que el experimento funcionaba en dos dimensiones en lugar de tres.
Por ejemplo, observó que, si bien cinco alfileres se disponían formando un pentágono estable alrededor del centro, seis alfileres no podían formar un hexágono estable. En cambio, un alfiler se desplazaba hacia el centro y los otros cinco formaban un pentágono alrededor del alfiler central, y esta disposición era estable. A medida que añadía más alfileres, estos se disponían formando anillos concéntricos alrededor del centro.
A partir de esto, Thomson creyó que los electrones en el átomo se organizaban en capas concéntricas y podían moverse dentro de estas capas, pero no se movían de una capa a otra, excepto cuando se añadían o restaban electrones del átomo.
Antes de 1906, Thomson consideraba que el peso atómico se debía a la masa de los electrones (a los que seguía llamando "corpúsculos"). Basándose en sus propias estimaciones de la masa de los electrones, un átomo necesitaría decenas de miles de electrones para explicar la masa. En 1906 utilizó tres métodos diferentes, dispersión de rayos X, absorción de rayos beta o propiedades ópticas de los gases, para estimar que "el número de corpúsculos no es muy diferente del peso atómico". [20] [21] Esto redujo el número de electrones a decenas o, como máximo, a un par de cientos y eso, a su vez, significaba que la esfera positiva en el modelo de Thomson contenía la mayor parte de la masa del átomo. Esto significaba que el trabajo de estabilidad mecánica de Thomson de 1904 y la comparación con la tabla periódica ya no eran válidos. [4] : 186 Además, la partícula alfa, tan importante para el siguiente avance en la teoría atómica de Rutherford, ya no se consideraría un átomo que contiene miles de electrones. [21] : 269
En 1907, Thomson publicó La teoría corpuscular de la materia [22] , que revisó sus ideas sobre la estructura del átomo y propuso nuevas vías de investigación.
En el capítulo 6, desarrolla más a fondo su experimento con alfileres imantados en agua, y proporciona una tabla ampliada. Por ejemplo, si se colocan 59 alfileres en la piscina, se organizarán en anillos concéntricos del orden 20-16-13-8-2 (del más externo al más interno).
En el capítulo 7, Thomson resumió sus resultados de 1906 sobre el número de electrones en un átomo. Incluyó una corrección importante: reemplazó el análisis de partículas beta por uno basado en los experimentos de rayos catódicos de August Becker , obteniendo un resultado que concordaba mejor con otros enfoques del problema. [21] : 273 Los experimentos de otros científicos en este campo habían demostrado que los átomos contienen muchos menos electrones de lo que Thomson creía anteriormente. Thomson ahora creía que el número de electrones en un átomo era un pequeño múltiplo de su peso atómico: "el número de corpúsculos en un átomo de cualquier elemento es proporcional al peso atómico del elemento - es un múltiplo, y no uno grande, del peso atómico del elemento." [23]
Esto significaba que casi toda la masa del átomo tenía que ser transportada por la esfera positiva, cualquiera que fuera su composición. Estimó que un átomo de hidrógeno es 1.700 veces más pesado que un electrón ( la medición actual es 1.837 ). [24] Thomson señala que ningún científico había encontrado aún una partícula con carga positiva más pequeña que un ion de hidrógeno. [25] También dice que la carga positiva de un átomo era un múltiplo de una unidad básica de carga positiva, igual a la carga negativa de un electrón. [26]
Las dificultades de Thomson con la dispersión beta en 1906 le llevaron a renovar su interés por el tema. Animó a J. Arnold Crowther a experimentar con la dispersión beta a través de láminas delgadas [27] y, en 1910, Thomson produjo una nueva teoría de la dispersión beta. [28] Las dos innovaciones de este artículo fueron la introducción de la dispersión desde la esfera positiva del átomo y el análisis de que la dispersión múltiple o compuesta era fundamental para los resultados finales. [21] : 273 Esta teoría y los resultados experimentales de Crowther se enfrentarían a la teoría de Rutherford y a los nuevos experimentos de Geiger y Mardsen con partículas alfa.
Otra innovación en el artículo de Thomson de 1910 fue que modeló cómo un átomo podría desviar una partícula beta entrante si la carga positiva del átomo existiera en unidades discretas de tamaño igual pero arbitrario, distribuidas uniformemente por todo el átomo, separadas por un espacio vacío, con cada unidad teniendo una carga positiva igual a la carga negativa del electrón. [29] Por lo tanto, Thomson estuvo cerca de deducir la existencia del protón , que fue algo que Rutherford finalmente hizo. En el modelo del átomo de Rutherford, los protones están agrupados en un núcleo muy pequeño, pero en el modelo alternativo de Thomson, las unidades positivas estaban distribuidas por todo el átomo.
En su artículo de 1910 "Sobre la dispersión de partículas electrificadas en rápido movimiento", Thomson presentó ecuaciones que modelaban cómo las partículas beta se dispersan en una colisión con un átomo. [30] [21] : 277
Thomson supuso que la carga positiva del átomo se distribuía uniformemente por todo su volumen, encapsulando los electrones. En su artículo de 1910, Thomson presentó la siguiente ecuación que aislaba el efecto de esta esfera positiva: [30] [21] : 278
donde k es la constante de Coulomb , q e es la carga de la partícula beta, q g es la carga de la esfera positiva, m es la masa de la partícula beta y R es el radio de la esfera. Como el átomo es miles de veces más pesado que la partícula beta, no se necesita ninguna corrección por retroceso.
Thomson no explicó cómo se desarrolló esta ecuación, pero el historiador John L. Heilbron proporcionó una suposición fundamentada que llamó aproximación "en línea recta". [31] Consideremos una partícula beta que pasa a través de la esfera positiva con su trayectoria inicial a una distancia lateral b del centro. Se supone que la trayectoria tiene una desviación muy pequeña y, por lo tanto, se trata aquí como una línea recta.

Dentro de una esfera de carga positiva distribuida uniformemente, la fuerza ejercida sobre la partícula beta en cualquier punto a lo largo de su trayectoria a través de la esfera estaría dirigida a lo largo del radio r con magnitud: [32] [33] : 106
La componente de fuerza perpendicular a la trayectoria y por tanto que desvía la trayectoria de la partícula sería:
Por lo tanto, el cambio lateral en el momento p y es
La desviación angular resultante, , viene dada por
donde p x es el momento horizontal promedio que se considera igual al momento entrante. Como ya sabemos que la desviación es muy pequeña, podemos considerarla igual a .
Para encontrar el ángulo de deflexión promedio , se suman el ángulo para cada valor de b y el L correspondiente a lo largo de la esfera de la cara, y luego se divide por el área de la sección transversal, según el teorema de Pitágoras . [21] : 278
Esto coincide con la fórmula de Thomson en su artículo de 1910.
Thomson modeló las colisiones entre una partícula beta y los electrones de un átomo calculando la desviación de una colisión y luego multiplicando por un factor el número de colisiones a medida que la partícula cruza el átomo.

Para los electrones dentro de una distancia arbitraria s de la trayectoria de la partícula beta, su distancia media será1/2 s . Por lo tanto, la desviación media por electrón será
donde q e es la carga elemental , k es la constante de Coulomb , m y v son la masa y la velocidad de la partícula beta.
Se sabía que el factor para el número de colisiones era la raíz cuadrada del número de electrones posibles a lo largo del camino. El número de electrones depende de la densidad de electrones a lo largo del camino de la partícula multiplicada por la longitud del camino L. La desviación neta causada por todos los electrones dentro de este cilindro arbitrario de efecto alrededor del camino de la partícula beta es
donde N 0 es el número de electrones por unidad de volumen y es el volumen de este cilindro.

Como Thomson calculó que la desviación sería muy pequeña, trata a L como una línea recta. Por lo tanto, donde b es la distancia de esta cuerda desde el centro. La media de está dada por la integral
Ahora podemos reemplazar en la ecuación para obtener la deflexión media :
donde N es el número de electrones en el átomo, igual a .
En su artículo de 1910, Thomson propuso un modelo alternativo en el que la carga positiva existe en unidades discretas separadas por espacio vacío, y esas unidades se distribuyen uniformemente en todo el volumen del átomo.

En este concepto, el ángulo de dispersión promedio de la partícula beta viene dado por:
donde σ es la relación entre el volumen ocupado por la carga positiva y el volumen del átomo completo. Thomson no explicó cómo llegó a esta ecuación.

Thomson investigó la estructura de los átomos a través de la dispersión de partículas beta , mientras que su antiguo alumno Ernest Rutherford estaba interesado en la dispersión de partículas alfa . Las partículas beta son electrones emitidos por la desintegración radiactiva, mientras que las partículas alfa son esencialmente átomos de helio, también emitidos en el proceso de desintegración. Las partículas alfa tienen considerablemente más impulso que las partículas beta y Rutherford descubrió que la materia dispersa las partículas alfa de maneras que el modelo de budín de pasas de Thomson no podía predecir.
Entre 1908 y 1913, Ernest Rutherford , Hans Geiger y Ernest Marsden colaboraron en una serie de experimentos en los que bombardearon láminas metálicas delgadas con un haz de partículas alfa y midieron la intensidad en función del ángulo de dispersión de las partículas. Descubrieron que la lámina metálica podía dispersar partículas alfa en más de 90°. [34] : 4 Esto no debería haber sido posible según el modelo de Thomson: la dispersión en ángulos grandes debería haber sido insignificante. Las probabilidades de que una partícula beta se dispersara más de 90° en tales circunstancias son astronómicamente pequeñas y, dado que las partículas alfa suelen tener mucho más momento que las partículas beta, su desviación debería ser aún menor. [35] Los modelos de Thomson simplemente no podían producir fuerzas electrostáticas de suficiente fuerza para causar una desviación tan grande. Las cargas en el modelo de Thomson eran demasiado difusas. Esto llevó a Rutherford a descartar el modelo de Thomson en favor de un nuevo modelo donde la carga positiva del átomo se concentra en un núcleo diminuto.
Rutherford realizó más descubrimientos convincentes. En el modelo de Thomson, la esfera de carga positiva era sólo un componente abstracto, pero Rutherford encontró algo concreto a lo que atribuir la carga positiva: partículas a las que llamó " protones ". Mientras que Thomson creía que el recuento de electrones estaba aproximadamente correlacionado con el peso atómico, Rutherford demostró que (en un átomo neutro) es exactamente igual al número atómico.
Thomson planteó la hipótesis de que la disposición de los electrones en el átomo determinaba de algún modo las líneas espectrales de un elemento químico. Estaba en lo cierto, pero no tenía nada que ver con la forma en que los átomos circulaban en una esfera de carga positiva. Los científicos acabaron descubriendo que tenía que ver con la forma en que los electrones absorben y liberan energía en cantidades discretas, moviéndose a través de niveles de energía que corresponden a espectros de emisión y absorción. Thomson no había incorporado la mecánica cuántica a su modelo atómico, que en aquel momento era un campo de la física muy nuevo. Niels Bohr y Erwin Schrödinger incorporaron posteriormente la mecánica cuántica al modelo atómico.
El artículo de Rutherford de 1911 sobre la dispersión de partículas alfa mostró que el modelo de dispersión de Thomson no podía explicar la dispersión de ángulos grandes y demostró que la dispersión múltiple no era necesaria para explicar los datos. Sin embargo, en los años inmediatamente posteriores a su publicación, pocos científicos tomaron nota. [4] Las predicciones del modelo de dispersión no se consideraron evidencia definitiva contra el modelo de pudín de pasas de Thomson. Thomson y Rutherford habían sido pioneros en la dispersión como técnica para sondear átomos, su confiabilidad y valor no estaban probados. Antes del artículo de Rutherford, la partícula alfa se consideraba un átomo, no una masa compacta. No estaba claro por qué debería ser una buena sonda. Además, el artículo de Rutherford no discutió los electrones atómicos vitales para problemas prácticos como la química o la espectroscopia atómica. [21] : 300 El modelo nuclear de Rutherford solo sería ampliamente aceptado después del trabajo de Niels Bohr .
El problema de Thomson en matemáticas busca la distribución óptima de cargas puntuales iguales en la superficie de una esfera. A diferencia del modelo atómico original de Thomson, la esfera en este modelo puramente matemático no tiene carga, y esto hace que todas las cargas puntuales se muevan hacia la superficie de la esfera por su repulsión mutua. Todavía no hay una solución general para el problema original de Thomson sobre cómo se organizan los electrones dentro de la esfera positiva de su modelo atómico. [36] [37]

El primer escritor conocido que comparó el modelo de Thomson con un pudín de ciruelas , un postre británico con pasas enteras, fue un periodista anónimo que escribió un artículo para la revista farmacéutica británica The Chemist and Druggist en agosto de 1906.
Mientras que la electricidad negativa se concentra en el corpúsculo extremadamente pequeño, la electricidad positiva se distribuye por un volumen considerable. Un átomo estaría así formado por diminutas partículas, los corpúsculos negativos, flotando en una esfera de electrificación positiva, como pasas en un budín de pasas parsimonioso, en la que las unidades de electricidad negativa se atraen hacia el centro, mientras que al mismo tiempo se repelen entre sí. [38]
Ni Thomson ni sus colegas utilizaron nunca esta analogía. Parece que se trató de una artimaña de los autores de divulgación científica para que el modelo fuera más fácil de entender para el público en general. [2]
Aunque el modelo de Thomson ha quedado obsoleto durante mucho tiempo por la mecánica cuántica, su problema de colocar cargas en una esfera sigue siendo digno de mención.