Los canales de potasio rectificadores de entrada ( Kir , IRK ) son un subconjunto específico de canales de potasio activados por lípidos . Hasta la fecha, se han identificado siete subfamilias en varios tipos de células de mamíferos, [1] plantas, [2] y bacterias. [3] Son activados por el fosfatidilinositol 4,5-bisfosfato ( PIP 2 ). El mal funcionamiento de los canales se ha implicado en varias enfermedades. [4] [5] Los canales IRK poseen un dominio de poro, homólogo al de los canales iónicos dependientes de voltaje , y segmentos transmembrana flanqueantes (TMS). Pueden existir en la membrana como homo o heterooligómeros y cada monómero posee entre 2 y 4 TMS. En términos de función, estas proteínas transportan potasio (K + ) , con una mayor tendencia a absorber K + que a exportar K + . [3] El proceso de rectificación interna fue descubierto por Denis Noble en las células del músculo cardíaco en la década de 1960 [6] y por Richard Adrian y Alan Hodgkin en 1970 en las células del músculo esquelético. [7]
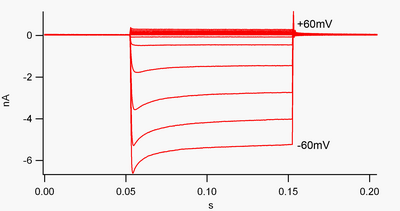
Un canal que es "rectificador hacia adentro" es aquel que hace pasar la corriente (carga positiva) más fácilmente en la dirección interna (dentro de la celda) que en la dirección externa (fuera de la celda). Se cree que esta corriente puede desempeñar un papel importante en la regulación de la actividad neuronal, al ayudar a estabilizar el potencial de membrana en reposo de la célula.
Por convención, la corriente entrante (carga positiva que entra en la celda) se muestra en la pinza de voltaje como una desviación hacia abajo, mientras que la corriente saliente (carga positiva que sale de la celda) se muestra como una desviación hacia arriba. En potenciales de membrana negativos al potencial de inversión del potasio , los canales de K + rectificadores internos apoyan el flujo de iones K + cargados positivamente hacia el interior de la célula, empujando el potencial de membrana de regreso al potencial de reposo. Esto se puede ver en la figura 1: cuando el potencial de membrana se fija en negativo con respecto al potencial de reposo del canal (por ejemplo, -60 mV), la corriente entrante fluye (es decir, la carga positiva fluye hacia el interior de la célula). Sin embargo, cuando el potencial de membrana es positivo respecto al potencial de reposo del canal (por ejemplo, +60 mV), estos canales pasan muy poca corriente. En pocas palabras, este canal pasa mucha más corriente hacia adentro que hacia afuera, en su rango de voltaje operativo. Estos canales no son rectificadores perfectos, ya que pueden pasar algo de corriente hacia afuera en el rango de voltaje de hasta aproximadamente 30 mV por encima del potencial de reposo.
Estos canales se diferencian de los canales de potasio que normalmente son responsables de repolarizar una célula después de un potencial de acción , como el rectificador retardado y los canales de potasio de tipo A. Esos canales de potasio más "típicos" conducen preferentemente corrientes de potasio hacia afuera (en lugar de hacia adentro) con potenciales de membrana despolarizados, y pueden considerarse como "rectificadores hacia afuera". Cuando se descubrió por primera vez, la rectificación interna se denominó "rectificación anómala" para distinguirla de las corrientes externas de potasio. [8]
Los rectificadores internos también se diferencian de los canales de potasio con dominio de poros en tándem , que son en gran medida responsables de las corrientes de "fuga" de K + . [9] Algunos rectificadores internos, denominados "rectificadores internos débiles", transportan corrientes K + salientes medibles a voltajes positivos al potencial de inversión K + (correspondientes, pero mayores que, las pequeñas corrientes por encima de la línea 0 nA en la figura 1). Ellos, junto con los canales de "fuga", establecen el potencial de membrana en reposo de la célula. Otros canales rectificadores internos, denominados "rectificadores internos fuertes", transportan muy poca corriente externa y son principalmente activos en voltajes negativos al potencial inverso K + , donde transportan corriente interna (las corrientes mucho más grandes por debajo de la línea 0 nA en Figura 1). [10]
El fenómeno de rectificación hacia adentro de los canales de Kir es el resultado del bloqueo de alta afinidad por poliaminas endógenas , concretamente espermina , así como iones de magnesio , que tapan el poro del canal en potenciales positivos, lo que resulta en una disminución de las corrientes hacia afuera. Este bloqueo dependiente del voltaje por parte de las poliaminas da como resultado una conducción eficiente de la corriente sólo en dirección hacia adentro. Si bien se comprende la idea principal del bloqueo de poliaminas, los mecanismos específicos siguen siendo controvertidos. [11]
Todos los canales de Kir requieren fosfatidilinositol 4,5-bifosfato (PIP 2 ) para su activación. [12] PIP 2 se une y activa directamente K ir 2.2 con propiedades similares a agonistas. [13] En este sentido, los canales Kir son canales iónicos activados por ligando PIP 2 .
Los canales de Kir se encuentran en múltiples tipos de células, incluidos macrófagos , células cardíacas y renales , leucocitos , neuronas y células endoteliales . Al mediar una pequeña corriente despolarizante de K + en potenciales de membrana negativos, ayudan a establecer el potencial de membrana en reposo y, en el caso del grupo K ir 3 , ayudan a mediar las respuestas inhibidoras de los neurotransmisores , pero sus funciones en la fisiología celular varían según el tipo de célula:
La dependencia del voltaje puede estar regulada por K + externo, por Mg 2+ interno , por ATP interno y/o por proteínas G. Los dominios P de los canales IRK exhiben una similitud de secuencia limitada con los de la familia VIC. Los rectificadores internos desempeñan un papel en la fijación de los potenciales de membrana celular y el cierre de estos canales tras la despolarización permite la aparición de potenciales de acción de larga duración con una fase de meseta. Los rectificadores internos carecen de las hélices de detección de voltaje intrínsecas que se encuentran en muchos canales de la familia VIC. En unos pocos casos, los de Kir1.1a, Kir6.1 y Kir6.2, por ejemplo, se ha propuesto la interacción directa con un miembro de la superfamilia ABC para conferir propiedades funcionales y reguladoras únicas al complejo heteromérico, incluida la sensibilidad al ATP. . Estos canales sensibles al ATP se encuentran en muchos tejidos del cuerpo. Hacen que la actividad del canal responda a la relación ATP/ADP citoplasmática (un aumento de ATP/ADP cierra el canal). Los receptores de sulfonilurea humanos SUR1 y SUR2 (spQ09428 y Q15527, respectivamente) son las proteínas ABC que regulan los canales Kir6.1 y Kir6.2 en respuesta al ATP, y CFTR (TC #3.A.1.208.4) puede regular Kir1.1a. [dieciséis]
Se han determinado la estructura cristalina [17] y la función [18] de los miembros bacterianos de la familia IRK-C. KirBac1.1, de Burkholderia pseudomallei , tiene 333 residuos de aminoacilo (aas) de largo con dos TMS N-terminales que flanquean un bucle P (residuos 1-150), y la mitad C-terminal de la proteína es hidrofílica. Transporta cationes monovalentes con la selectividad: K ≈ Rb ≈ Cs ≫ Li ≈ Na ≈ NMGM ( N -metil- D -glucamina protonada ). La actividad es inhibida por Ba 2+ , Ca 2+ y un pH bajo. [18]
Hay siete subfamilias de canales K ir , denominadas K ir 1 – K ir 7. [1] Cada subfamilia tiene varios miembros (es decir, K ir 2.1, K ir 2.2, K ir 2.3, etc.) que tienen aminoácidos casi idénticos. secuencias en especies de mamíferos conocidas.
Los canales de Kir se forman a partir de proteínas de membrana homotetraméricas . Cada una de las cuatro subunidades proteicas idénticas está compuesta por dos hélices alfa que atraviesan la membrana (M1 y M2). Se pueden formar heterotetrámeros entre miembros de la misma subfamilia (es decir, K ir 2.1 y K ir 2.3) cuando los canales están sobreexpresados.