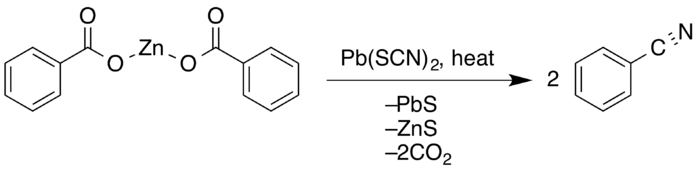
La síntesis de nitrilos de Letts es una reacción química de ácidos carboxílicos aromáticos con tiocianatos metálicos para formar nitrilos . La reacción incluye la pérdida de dióxido de carbono e hidrosulfuro de potasio . La reacción de sustitución básica polar fue descubierta en 1872 por Edmund A. Letts . [1] [2]

En 1857 Hugo Schiff observó que la reacción entre el cloruro de benzoilo y el cianuro de potasio producía el benzonitrilo deseado . [3] El trabajo realizado posteriormente por el químico británico Edmund A. Letts profundizó mucho más en la síntesis de nitrilos. Al intentar primero añadir grupos ciano al ácido acético , obtuvo una mezcla de acetamida y sulfuro de carbonilo . Sin embargo, en 1872 demostró que tratar una proporción molecular de 2:1 de ácido benzoico y tiocianato de potasio con calor durante varias horas también producía nitrilos con solo una pequeña cantidad de amida con un rendimiento de aproximadamente el 40%. [4]
G. Krüss amplió el trabajo de Letts en 1884, produciendo mejores rendimientos utilizando tiocianato de plomo (II) . [5] En 1916, EE Reid descubrió que la destilación en seco de la sal de zinc (II) del ácido con un exceso del 20% de tiocianato de plomo (II) dio una conversión del 86% y un rendimiento del 91%, casi el doble del producido por Letts. [6]
Kekulé propuso el mecanismo de reacción en 1873. [7]
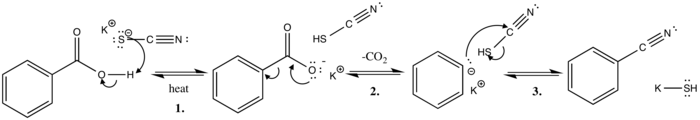
En este mecanismo de reacción de sustitución básica polar, el ion tiocianato extrae el protón ácido del ácido benzoico mientras se calienta. Esto produce la base conjugada (estabilizada por estructuras de resonancia ) y el ácido tiocianico .
El siguiente paso implica la evolución del dióxido de carbono, donde un par solitario de electrones se mueve desde el oxígeno cargado negativamente para formar un doble enlace con el carbono carboxílico. El enlace sigma entre el anillo y el grupo carboxilo se rompe, el par de electrones se mueve hacia el anillo y se deslocaliza a través de estructuras de resonancia.
El paso final del mecanismo implica el ataque del anión fenilo que ataca al cianocarbono, empujando el par de electrones hacia el azufre, que difunde fácilmente la carga negativa y se estabiliza aún más por el ion potasio , dando como resultado el producto final benzonitrilo e hidrosulfuro de potasio.
Los nitrilos aromáticos tienen algunas aplicaciones, incluida la polirrecombinación para formar polímeros , [8] a veces se estudian como moléculas biológicamente activas [9] y experimentan reacciones de Ritter para formar amidas . [10]

El benzonitrilo, el producto original de Letts, tiene múltiples usos como reactivo versátil y como disolvente . Los benzonitrilos sustituidos son importantes en muchos campos, incluidos los farmacéuticos. El benzonitrilo es un precursor en la síntesis de Fadrozol , un inhibidor de la aromatasa utilizado en el tratamiento del cáncer de mama . [11] El 4-(trifluorometil)benzonitrilo, producido por la cianación catalizada por níquel del 4-clorobenzotrifluoruro, es un precursor del antidepresivo Fluvoxamina . [12]

El benzonitrilo también puede actuar como ligando en catálisis asimétrica , coordinándose con metales de transición y formando ácidos de Lewis . [13] [14]
Para la síntesis de nitrilos:
Para reacciones de nitrilos:
{{cite book}}: |journal=ignorado ( ayuda )