El síndrome de Cockayne ( CS ), también llamado síndrome de Neill-Dingwall , es un trastorno neurodegenerativo autosómico recesivo raro y mortal que se caracteriza por retraso del crecimiento, deterioro del desarrollo del sistema nervioso , sensibilidad anormal a la luz solar ( fotosensibilidad ), trastornos oculares y envejecimiento prematuro . [1] [2] [3] El retraso en el crecimiento y los trastornos neurológicos son criterios para el diagnóstico, mientras que la fotosensibilidad, la pérdida de audición, las anomalías oculares y las caries son otras características muy comunes. [3] Son posibles problemas con alguno o todos los órganos internos. Se asocia con un grupo de trastornos llamados leucodistrofias , que son afecciones caracterizadas por la degradación de la materia blanca neurológica . Hay dos tipos principales de síndrome de Cockayne: el síndrome de Cockayne tipo A (CSA) , que surge de mutaciones en el gen ERCC8 , y el síndrome de Cockayne tipo B (CSB) , que resulta de mutaciones en el gen ERCC6 . [4]
El trastorno subyacente es un defecto en un mecanismo de reparación del ADN . [5] A diferencia de otros defectos de reparación del ADN, los pacientes con síndrome de Cockayne no están predispuestos al cáncer o a las infecciones. [6] El síndrome de Cockayne es una enfermedad rara pero destructiva que suele provocar la muerte en la primera o segunda década de vida. Se conoce la mutación de genes específicos en el síndrome de Cockayne, pero aún no se comprenden bien sus efectos generalizados y su relación con la reparación del ADN. [6]
El síndrome de Neill-Dingwall debe su nombre al médico inglés Edward Alfred Cockayne (1880-1956), que lo describió por primera vez en 1936 y lo volvió a describir en 1946. [7] El síndrome de Neill-Dingwall debe su nombre a Mary M. Dingwall y Catherine A. Neill. [7] Estos dos científicos describieron el caso de dos hermanos con síndrome de Cockayne y afirmaron que se trataba de la misma enfermedad descrita por Cockayne. En su artículo, los dos contribuyeron a los signos de la enfermedad a través de su descubrimiento de calcificaciones en el cerebro. También compararon el síndrome de Cockayne con lo que ahora se conoce como síndrome de progeria de Hutchinson-Gilford (HGPS), entonces llamado progeria, debido al envejecimiento avanzado que caracteriza a ambos trastornos. [7]
Si se produce hiperoxia o exceso de oxígeno en el cuerpo, el metabolismo celular produce varias formas altamente reactivas de oxígeno llamadas radicales libres . Esto puede causar daño oxidativo a los componentes celulares, incluido el ADN . En las células normales, nuestro cuerpo repara las secciones dañadas. En el caso de esta enfermedad, debido a defectos sutiles en la transcripción , la maquinaria genética de los niños para sintetizar las proteínas que necesita el cuerpo no funciona a su capacidad normal. Con el tiempo, decía esta teoría, resulta en un fracaso del desarrollo y la muerte. Cada minuto, el cuerpo bombea de 10 a 20 litros de oxígeno a través de la sangre , llevándolo a miles de millones de células en nuestros cuerpos. En su forma molecular normal , el oxígeno es inofensivo. Sin embargo, el metabolismo celular que involucra al oxígeno puede generar varios radicales libres altamente reactivos. Estos radicales libres pueden causar daño oxidativo a los componentes celulares, incluido el ADN. En una célula humana promedio , se producen varios miles de lesiones en el ADN todos los días. Muchas de estas lesiones son resultado de daño oxidativo . Cada lesión (una sección dañada del ADN) debe ser extirpada y el ADN reparado para preservar su función normal. El ADN no reparado puede perder su capacidad de codificar proteínas. También pueden producirse mutaciones. Estas mutaciones pueden activar oncogenes o silenciar genes supresores de tumores. Según las investigaciones, el daño oxidativo en los genes activos no se repara preferentemente y, en los casos más graves, la reparación se ralentiza en todo el genoma . La acumulación resultante de daño oxidativo podría perjudicar las funciones normales del ADN e incluso desencadenar un programa de muerte celular (apoptosis). Los niños con esta enfermedad no reparan los genes activos donde se produce el daño oxidativo. Normalmente, la reparación del daño oxidativo es más rápida en los genes activos (que constituyen menos del cinco por ciento del genoma) que en las regiones inactivas del ADN. La acumulación resultante de daño oxidativo podría perjudicar las funciones normales del ADN e incluso desencadenar un programa de muerte celular ( apoptosis ). [12]
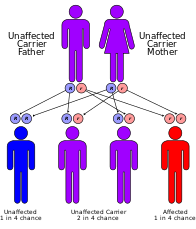
El síndrome de Cockayne se clasifica genéticamente de la siguiente manera: [13]
A diferencia de las células con capacidad de reparación normal, las células deficientes en CSA y CSB son incapaces de reparar preferentemente los dímeros de pirimidina de ciclobutano inducidos por la acción de la luz ultravioleta (UV) sobre la cadena molde de los genes transcritos activamente . [14] Esta deficiencia refleja la pérdida de la capacidad de realizar el proceso de reparación del ADN conocido como reparación por escisión de nucleótidos acoplada a la transcripción (TC-NER). [15]
Dentro de la célula dañada, la proteína CSA normalmente se localiza en sitios de daño del ADN , particularmente enlaces cruzados entre cadenas, roturas de doble cadena y algunos monoaductos. [16] La proteína CSB también se recluta normalmente en sitios dañados del ADN, y su reclutamiento es más rápido y robusto de la siguiente manera: enlaces cruzados entre cadenas > roturas de doble cadena > monoaductos > daño oxidativo. [16] La proteína CSB forma un complejo con otra proteína de reparación del ADN, SNM1A ( DCLRE1A ), una exonucleasa 5' – 3' , que se localiza en enlaces cruzados entre cadenas de una manera dependiente de la transcripción. [17] La acumulación de proteína CSB en sitios de roturas de doble cadena de ADN ocurre de una manera dependiente de la transcripción y facilita la reparación recombinatoria homóloga de las roturas. [18] Durante la fase G0 / G1 del ciclo celular, el daño del ADN puede desencadenar un proceso de reparación recombinatoria dependiente de CSB que utiliza una plantilla de ARN (en lugar de ADN ). [19]
Las características de envejecimiento prematuro del CS probablemente se deben, al menos en parte, a las deficiencias en la reparación del ADN (véase la teoría del daño del ADN en el envejecimiento ). [15]
Las personas con este síndrome tienen cabezas más pequeñas de lo normal ( microcefalia ), son de baja estatura ( enanismo ), sus ojos parecen hundidos y tienen un aspecto "envejecido". A menudo tienen extremidades largas con contracturas articulares (incapacidad para relajar el músculo en una articulación), una espalda encorvada ( cifosis ) y pueden ser muy delgados ( caquéticos ), debido a una pérdida de grasa subcutánea. Su barbilla pequeña, orejas grandes y nariz puntiaguda y delgada a menudo dan una apariencia envejecida. [9] La piel de las personas con síndrome de Cockayne también se ve afectada con frecuencia: hiperpigmentación, venas varicosas o arañas vasculares ( telangiectasia ), [9] y una sensibilidad grave a la luz solar son comunes, incluso en personas sin XP-CS. A menudo, los pacientes con síndrome de Cockayne se queman gravemente o forman ampollas con muy poca exposición al calor. Los ojos de los pacientes pueden verse afectados de diversas formas y las anomalías oculares son comunes en el CS. Las cataratas y la opacidad de la córnea ( opacidad corneal ) son comunes. Puede producirse pérdida y daño de los nervios del nervio óptico, causando atrofia óptica. [3] El nistagmo , o movimiento involuntario de los ojos, y las pupilas que no se dilatan demuestran una pérdida de control del movimiento muscular voluntario e involuntario. [9] Una pigmentación retiniana en sal y pimienta también es un signo típico. El diagnóstico se determina mediante una prueba específica para la reparación del ADN, que mide la recuperación del ARN después de la exposición a la radiación UV. A pesar de estar asociado con genes involucrados en la reparación por escisión de nucleótidos (NER), a diferencia del xeroderma pigmentosum , el CS no está asociado con un mayor riesgo de cáncer. [6]
En los pacientes con síndrome de Cockayne, las células irradiadas con rayos UV muestran una síntesis reducida de ADN y ARN. https://emedicine.medscape.com/article/1115866-workup#c5 Los estudios de laboratorio son principalmente útiles para descartar otros trastornos. Por ejemplo, la radiografía ósea, las pruebas endocrinológicas y los estudios de rotura cromosómica pueden ayudar a excluir trastornos incluidos en el diagnóstico diferencial. [ cita requerida ]
La tomografía computarizada cerebral en pacientes con síndrome de Cockayne puede revelar calcificaciones y atrofia cortical. [15]
Es posible la evaluación prenatal. El cultivo de células del líquido amniótico se utiliza para demostrar que las células fetales presentan deficiencias en la síntesis de ARN después de la irradiación con rayos UV. [ cita requerida ]
Los estudios de imagen revelan una ausencia generalizada de las vainas de mielina de las neuronas en la materia blanca del cerebro y una atrofia general de la corteza. [6] También se han encontrado calcificaciones en el putamen , un área del prosencéfalo que regula los movimientos y ayuda en algunas formas de aprendizaje, [9] junto con la corteza. [7] Además, la atrofia del área central del cerebelo encontrada en pacientes con síndrome de Cockayne también podría resultar en la falta de control muscular, particularmente involuntario, y la mala postura que se observa típicamente. [ cita requerida ]
No existe una cura permanente para este síndrome, aunque los pacientes pueden ser tratados sintomáticamente. El tratamiento generalmente incluye fisioterapia y cirugías menores en los órganos afectados, como la extracción de cataratas. [3] También se recomienda usar protector solar de alto factor y ropa protectora porque los pacientes con síndrome de Cockayne son muy sensibles a la radiación UV. [20] Una nutrición óptima también puede ayudar. Se recomienda asesoramiento genético para los padres, ya que el trastorno tiene un 25% de probabilidades de transmitirse a futuros hijos, y las pruebas prenatales también son una posibilidad. [3] Otro aspecto importante es la prevención de la recurrencia del síndrome de Cockayne en otros hermanos. La identificación de los defectos genéticos involucrados permite ofrecer asesoramiento genético y pruebas de diagnóstico prenatal a los padres que ya tienen un hijo afectado. [21]
Actualmente, hay dos proyectos en marcha centrados en el desarrollo de terapia génica para el síndrome de Cockayne. El primer proyecto, dirigido por la Asociación Viljem Julijan para Niños con Enfermedades Raras, tiene como objetivo desarrollar una terapia génica específicamente para el síndrome de Cockayne tipo B. [22] El segundo proyecto, dirigido por la Iniciativa de Investigación Riaan, está dedicado al desarrollo de una terapia génica para el síndrome de Cockayne tipo A. [23]
El pronóstico para aquellos con síndrome de Cockayne es malo, ya que la muerte generalmente ocurre a la edad de 12 años . [24] El pronóstico para el síndrome de Cockayne varía según el tipo de enfermedad. Hay tres tipos de síndrome de Cockayne según la gravedad y la aparición de los síntomas. Sin embargo, las diferencias entre los tipos no siempre son claras, y algunos investigadores creen que los signos y síntomas reflejan un espectro en lugar de tipos distintos: El síndrome de Cockayne tipo A (CSA) se caracteriza por un desarrollo normal hasta que el niño tiene 1 o 2 años, momento en el que el crecimiento se ralentiza y se notan retrasos en el desarrollo. Los síntomas no son evidentes hasta que el niño tiene 1 año. La esperanza de vida para el tipo A es de aproximadamente 10 a 20 años. Estos síntomas se observan en niños con CS tipo 1. El síndrome de Cockayne tipo B (CSB), también conocido como "síndrome cerebro-óculo-facio-esquelético (COFS)" (o "síndrome de Pena-Shokeir tipo B"), es el subtipo más grave. Los síntomas están presentes al nacer y el desarrollo normal del cerebro se detiene después del nacimiento. La esperanza de vida media de los niños con el tipo B es de hasta 7 años. Estos síntomas se observan en los niños con síndrome de Cockayne tipo 2. El síndrome de Cockayne tipo C (SCC) aparece más tarde en la infancia con síntomas más leves que los otros tipos y una progresión más lenta del trastorno. Las personas con este tipo de síndrome de Cockayne viven hasta la edad adulta, con una esperanza de vida media de 40 a 50 años. Estos síntomas se observan en el síndrome de Cockayne tipo 3. [15]
El síndrome de Cockayne es poco frecuente en todo el mundo. No se ha descrito ninguna predilección racial para el síndrome de Cockayne. No se ha descrito ninguna predilección sexual para el síndrome de Cockayne; la proporción de varones a mujeres es igual. El síndrome de Cockayne I (CS-A) se manifiesta en la infancia. El síndrome de Cockayne II (CS-B) se manifiesta al nacer o en la infancia y tiene un peor pronóstico. [15]
La investigación reciente de enero de 2018 menciona diferentes características del síndrome de Down que se observan a nivel mundial con similitudes y diferencias: el síndrome de Down tiene una incidencia de 1 en 250.000 nacidos vivos y una prevalencia de aproximadamente 1 por 2,5 millones, lo que es notablemente consistente en varias regiones a nivel mundial: [25] [26]