La reacción de Corey-Fuchs , también conocida como reacción de Ramírez-Corey-Fuchs , es una serie de reacciones químicas diseñadas para transformar un aldehído en un alquino . [1] [2] [3] La formación de 1,1-dibromoolefinas a través de fosfino-dibromometilenos fue descubierta originalmente por Desai, McKelvie y Ramirez. [4] La fosfina se puede sustituir parcialmente por polvo de zinc, lo que puede mejorar los rendimientos y simplificar la separación del producto. [1] El segundo paso de la reacción para convertir dibromoolefinas en alquinos se conoce como reordenamiento de Fritsch-Buttenberg-Wiechell . La transformación general combinada de un aldehído en un alquino mediante este método lleva el nombre de sus desarrolladores, los químicos estadounidenses Elias James Corey y Philip L. Fuchs.

Mediante la elección adecuada de la base, a menudo es posible detener la reacción en el 1-bromoalquino, un grupo funcional útil para una transformación adicional.
La reacción de Corey-Fuchs se basa en un caso especial de la reacción de Wittig , donde se utilizan dos equivalentes de trifenilfosfina con tetrabromuro de carbono para producir trifenilfosfina-dibromometileniluro.

Este iluro sufre una reacción de Wittig cuando se expone a un aldehído. Alternativamente, el uso de una cetona genera una gema-dibromoalqueno.
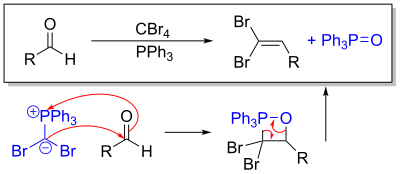
La segunda parte de la reacción convierte el intermedio gem-dibromoalqueno aislable en alquino. Los estudios de etiquetado de deuterio muestran que este paso se produce mediante un mecanismo de carbeno. Al intercambio de bromuro de litio le sigue una eliminación α para producir el carbeno. El desplazamiento 1,2 produce entonces el alquino terminal marcado con deuterio. [2] La incorporación del 50% de H podría explicarse por la desprotonación del deuterio terminal (ácido) con exceso de BuLi.

{{cite book}}: Mantenimiento CS1: nombres numéricos: lista de autores ( enlace )