La reacción de Barton-Kellogg es una reacción de acoplamiento entre un compuesto diazo y una tiocetona , que da un alqueno a través de un intermedio de episulfuro . [1] [2] [3] La reacción de Barton-Kellogg también se conoce como olefinación de Barton-Kellogg [4] y síntesis de olefinas de Barton . [5]

Esta reacción fue iniciada por Hermann Staudinger , [6] y también se conoce con el nombre de acoplamiento diazo-tiocetona tipo Staudinger .
En el mecanismo de reacción para esta reacción, el compuesto diazo reacciona como un 1,3-dipolo en una cicloadición 1,3-dipolar con la tiocetona para dar un anillo de tiadiazolina de 5 miembros. Este intermedio es inestable; extruye una molécula de nitrógeno para formar un iluro de tiocarbonilo , que luego se cicla para formar un episulfuro estable . La trifenilfosfina reacciona como un nucleófilo , abriendo el anillo de tres miembros para formar un sulfafosfatano. De manera similar a la reacción de Wittig , esta estructura luego expulsa sulfuro de trifenilfosfina para producir un alqueno.

El compuesto diazo puede obtenerse a partir de una cetona por reacción con hidrazina para formar una hidrazona seguida de oxidación . Existen muchos reactivos para esta conversión, por ejemplo, óxido de plata (I) y (bis (trifluoroacetoxi) yodo) benceno . [7] La tiocetona necesaria para esta reacción puede obtenerse a partir de una cetona y pentasulfuro de fósforo . La desulfuración del episulfuro puede lograrse con muchas fosfinas y también con polvo de cobre .
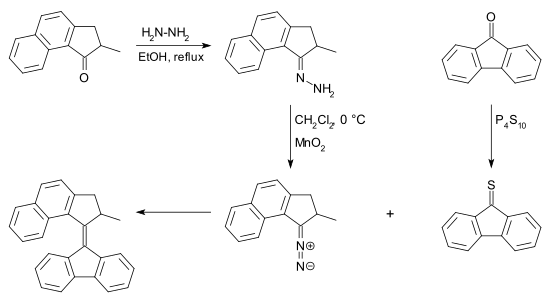
La principal ventaja de esta reacción con respecto a la reacción de McMurry es que puede producirse con dos cetonas diferentes. En este sentido, el acoplamiento diazo-tiocetona es un acoplamiento cruzado en lugar de un acoplamiento homogéneo.