La malato deshidrogenasa (oxalacetato-descarboxilante) (NADP + ) ( EC 1.1.1.40) o enzima NADP-málica (NADP-ME) es una enzima que cataliza la reacción química en presencia de un ion metálico bivalente: [1]
Así , los dos sustratos de esta enzima son (S)-malato y NADP + , mientras que sus tres productos son piruvato , CO2 y NADPH . El malato se oxida a piruvato y CO2 , y el NADP + se reduce a NADPH.
Esta enzima pertenece a la familia de las oxidorreductasas , en concreto las que actúan sobre el grupo CH-OH del donante con NAD + o NADP + como aceptor. El nombre sistemático de esta clase de enzimas es (S)-malato:NADP + oxidorreductasa (oxalacetato-descarboxilante) . Esta enzima participa en el metabolismo del piruvato y en la fijación de carbono . La enzima NADP-málica es una de las tres enzimas de descarboxilación utilizadas en los mecanismos de concentración de carbono inorgánico de las plantas C4 y CAM . Las otras son la enzima NAD-málica y la PEP carboxiquinasa . [2] [3] Aunque a menudo predomina una de las tres descarboxilasas fotosintéticas, también se ha demostrado que existe el funcionamiento simultáneo de las tres. [4]
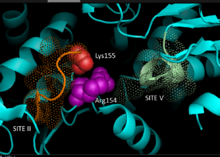
Basado en datos de cristalografía de enzimas málicas homólogas dependientes de NADP de origen mamífero, se ha desarrollado un modelo 3D para la vía C 4 NADP-ME en plantas, identificando los residuos clave implicados en la unión del sustrato o la catálisis. La unión de dinucleótidos implica dos motivos GXGXXG ricos en glicina , un surco hidrofóbico que involucra al menos seis residuos de aminoácidos y un residuo cargado negativamente al final de la cadena βB. [5] [6] La secuencia primaria del primer motivo, 240 GLGDLG 245 , es un marcador de consenso para la unión de fosfato, lo que evidencia su participación en la unión de NADP, mientras que el otro motivo rico en glicina adopta un pliegue de Rossmann clásico , también un marcador típico de NADP. unión del cofactor . [7] Los experimentos de mutagénesis en maíz NADP-ME han respaldado el modelo actual. [1] La sustitución de glicina por valina en cualquiera de las regiones del motivo dejó a la enzima completamente inactiva, mientras que el análisis espectral no indicó cambios importantes con respecto a la forma natural. Los datos sugieren un deterioro directo en un residuo clave involucrado en la unión o catálisis en lugar de un residuo entre dominios que influye en la estabilidad conformacional. Además, se ha demostrado que un residuo clave de arginina en el sitio 237 interactúa tanto con sustratos de malato como de NADP + , formando interacciones electrostáticas clave favorables para el grupo ácido carboxílico y fosfato con carga negativa, respectivamente. Aún no se ha determinado si el residuo desempeña un papel en la unión del sustrato o en el posicionamiento del sustrato para la catálisis. [8] El residuo de lisina 255 ha sido implicado como base catalítica para la reactividad de las enzimas; sin embargo, aún se necesitan más estudios para establecer de manera concluyente su papel bioquímico. [1]
A partir de 2007 , se han resuelto [actualizar]3 estructuras para esta clase de enzimas, con los códigos de acceso de PDB 1GQ2, 1GZ4 y 2AW5. [ cita necesaria ]
En un contexto más amplio, las enzimas málicas se encuentran dentro de una amplia gama de organismos eucariotas , desde hongos hasta mamíferos, y más allá de eso, se ha demostrado que se localizan en una variedad de ubicaciones subcelulares, incluidos el citosol , las mitocondrias y el cloroplasto . C 4 NADP-ME, específicamente, se encuentra en plantas localizado en los cloroplastos de la vaina del haz . [1]
Durante la fotosíntesis de C 4 , una vía evolucionada para aumentar las concentraciones localizadas de CO 2 bajo la amenaza de una fotorrespiración mejorada , el CO 2 se captura dentro de las células del mesófilo , se fija como oxaloacetato , se convierte en malato y se libera internamente dentro de las células de la vaina del haz para alimentar directamente la actividad de RuBisCO . [9] Esta liberación de CO 2 fijado , provocada por la descarboxilación favorable del malato en piruvato , está mediada por la enzima málica dependiente de NADP. De hecho, la importancia de la actividad NADP-ME en la conservación de CO 2 se evidencia en un estudio realizado con plantas transgénicas que exhiben una mutación de pérdida de función de NADP-ME. Las plantas con la mutación experimentaron un 40% de la actividad del NADP-ME de tipo salvaje y lograron una absorción de CO 2 significativamente reducida incluso con niveles intercelulares elevados de CO 2 , lo que evidencia la importancia biológica del NADP-ME en la regulación del flujo de carbono hacia el ciclo de Calvin . [10] [11]
Se ha demostrado que la expresión de NADP-ME está regulada por factores de estrés abiótico . Para las plantas CAM , las condiciones de sequía hacen que el estoma permanezca en gran medida cerrado para evitar la pérdida de agua por evapotranspiración , lo que desafortunadamente conduce a la falta de CO 2 . En compensación, el estoma cerrado activa la traducción de NADP-ME para reforzar la alta eficiencia de la asimilación de CO 2 durante los breves intervalos de ingesta de CO 2 , permitiendo que continúe la fijación de carbono .
Además de la regulación en una escala de tiempo más larga mediante el control de la expresión, la regulación en una escala de tiempo más corta puede ocurrir a través de mecanismos alostéricos . Se ha demostrado que C 4 NADP-ME está parcialmente inhibido por su sustrato , el malato, lo que sugiere dos sitios de unión independientes: uno en el sitio activo y otro en un sitio alostérico. Sin embargo, el efecto inhibidor muestra una dependencia del pH , existente a un pH de 7 pero no a un pH de 8. El control de la actividad enzimática debido a los cambios de pH se alinea con la hipótesis de que NADP-ME es más activo mientras la fotosíntesis está en progreso: Activo Las reacciones luminosas provocan un aumento de la basicidad dentro del estroma del cloroplasto , la ubicación de NADP-ME, lo que conduce a una disminución del efecto inhibidor del malato sobre NADP-ME y, por lo tanto, promueve un estado más activo. Por el contrario, las reacciones luminosas más lentas provocan un aumento de la acidez dentro del estroma, lo que promueve la inhibición de NADP-ME por el malato. Debido a que los productos de alta energía de las reacciones luminosas , NADPH y ATP , son necesarios para que se desarrolle el ciclo de Calvin , una acumulación de CO 2 sin ellos no es útil, lo que explica la necesidad del mecanismo regulador. [12]
Esta proteína puede utilizar el modelo de regulación alostérica de la morfeína . [13]
La enzima NADP-málica, como todas las demás C 4 descarboxilasas, no evolucionó de novo para la combinación de CO 2 para ayudar a RuBisCO . [14] Más bien, NADP-ME se transformó directamente a partir de una especie C 3 en la fotosíntesis , e incluso tuvo orígenes anteriores a partir de un antiguo ancestro cistólico . En el citosol , la enzima existía como una serie de isoformas de mantenimiento destinadas a una variedad de funciones, incluido el mantenimiento del nivel de malato durante la hipoxia , la separación de microsporas y la defensa de patógenos . En lo que respecta al mecanismo de evolución, se cree que la funcionalidad C 4 se debe a un error de duplicación genética tanto dentro de las regiones promotoras , lo que desencadena la sobreexpresión en las células de la vaina del haz, como dentro de la región codificante, generando una neofuncionalización . [15] La selección de la función de conservación de CO 2 , así como la utilización mejorada de agua y nitrógeno en condiciones de estrés, estuvo determinada por presiones naturales. [dieciséis]